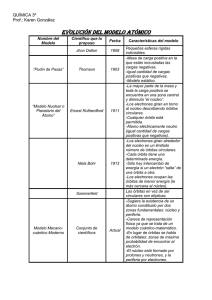
¿Qué es un espectro
Anuncio
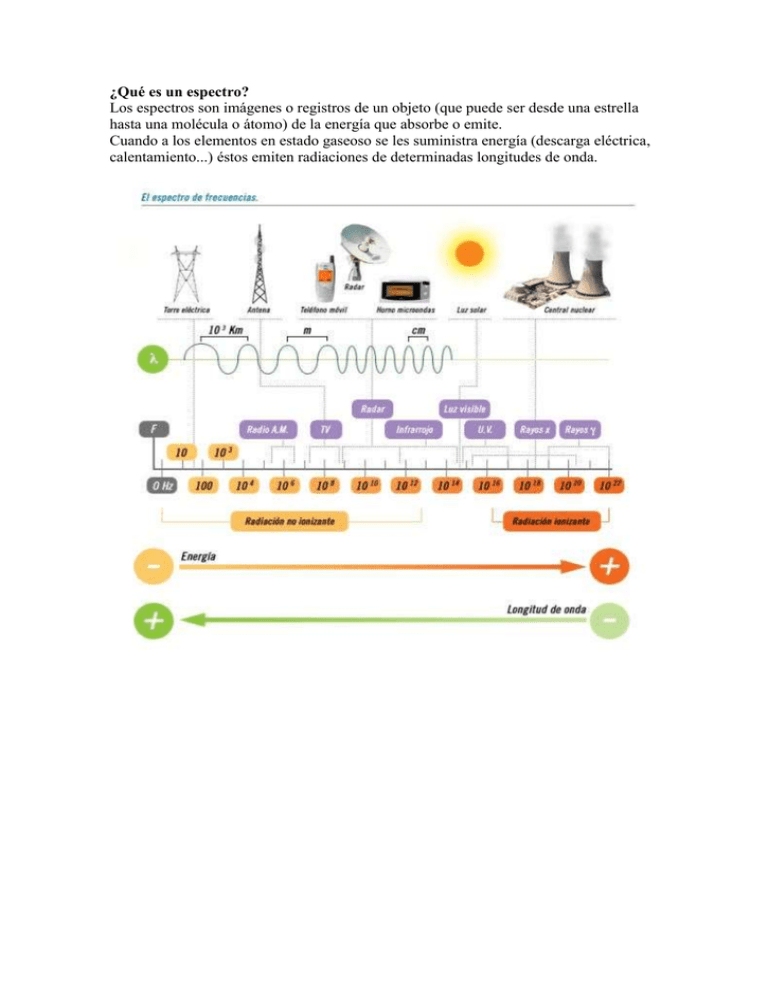
¿Qué es un espectro? Los espectros son imágenes o registros de un objeto (que puede ser desde una estrella hasta una molécula o átomo) de la energía que absorbe o emite. Cuando a los elementos en estado gaseoso se les suministra energía (descarga eléctrica, calentamiento...) éstos emiten radiaciones de determinadas longitudes de onda. Tipos: Espectro de emisión.Son originados por radiaciones emitidas de cuerpos incandescentes. Ejemplos.Espectro de emisión del Sodio. Espectro de emisión del Helio. Espectro de emisión del Hidrógeno. Espectro de Absorción.Los espectros de absorción son obtenidos por absorción parcial de las radiaciones emitidas por un foco luminoso cuando la luz producida por él atraviesa una sustancia en estado gaseoso, ya que cualquier gas o vapor absorbe, a cualquier temperatura, las mismas radiaciones que es capaz de emitir si estuviera incandescente. Ejemplos. Espectro de absorción del Mercurio. Espectro de absorción del Hidrógeno. Espectro de absorción del Neón. Espectro Continuo.El espectro continuo, también llamado térmico o de cuerpo negro, es emitido por cualquier objeto que irradie calor (es decir, que tenga una temperatura distinta al 0 absoluto = 273°C). Cuando su luz es dispersada, aparece una banda continua con algo de radiación a todas las longitudes de onda. Por ejemplo, cuando la luz del Sol pasa a través de un prisma, su luz se dispersa en los siete colores del arco iris (donde cada color es una longitud de onda diferente). Espectro continuo en luz visible. Espectro discontinuo.Se conoce como espectro discontinuo a la luz a la luz que se obtiene al poner incandescente una muestra de un elemento químico en estado gaseoso (muy pocos átomos). Para cada elemento, su espectro discontinuo es diferente y característico. Espectro discontinuo. FUNDAMENTO TEÓRICO II Busca ahora información sobre el modelo atómico de Borh: a. En qué consiste (escribe sus principales características). Postulados del modelo atómico de Borh. Lo original de la teoría de Bohr es que afirma: a) Que los electrones solamente pueden estar en órbitas fijas muy determinadas, negando todas las demás. b) Que en cada una de estas órbitas, los electrones tienen asociada una determinada energía, que es mayor en las órbitas más externas. c) Que los electrones no irradian energía al girar en torno al núcleo. d) Que el átomo emite o absorbe energía solamente cuando un electrón salta de una órbita a otra. e) Que estos saltos de órbita se producen de forma espontánea. f) Que en el salto de una órbita a otra, el electrón no pasa por ninguna órbita intermedia. La característica esencial del modelo de Bohr es que, según él, los electrones se ubican alrededor del núcleo únicamente a ciertas distancias bien determinadas. El por qué de esta disposición se estableció más tarde, cuando el desarrollo de la mecánica cuántica alcanzó su plena madurez. El modelo de Bohr es muy simple y recuerda al modelo planetario de Copérnico, los planetas describiendo órbitas circulares alrededor del Sol. El electrón de un átomo describe también órbitas circulares, pero los radios de estas órbitas no pueden tener cualquier valor, sino valores fijos. Cuando un electrón salta de una órbita a otra, lo hace sin pasar por órbitas intermedias. Esto es una afirmación que rompe las ideas normales que tenemos, porque no podemos visualizar cómo sucede esto exactamente. b. Adjunta imágenes del modelo c. ¿Hubo algún experimento que justificara que Borh desarrollara este modelo atómico? En caso afirmativo descríbelo y escribe las consecuencias que se extraen del experimento. Modelo mecánico del átomo de Bohr Presenta un montaje experimental que permite demostrar la aparición de ondas estacionarias circulares en un anillo de caucho que se hace vibrar. Considerando que el anillo representa la órbita seguida por el electrón alrededor del protón, y que el electrón puede visualizarse como una onda de materia, se encuentra que solo para ciertas frecuencias de vibración del sistema aparecen estados estacionarios. Estos corresponden, según la analogía establecida, a las órbitas estables planteadas por Bohr en su modelo. Materiales & Equipos Generador de señales Parlante Tabla de madera con anillo de cauchos Descripción del experimento El modelo del átomo de hidrógeno planteado por Niels Bohr en 1.913 consiste en un núcleo conformado por un protón sobre el que gira un electrón siguiendo una órbita circular. El electrón no se precipita hacia el núcleo por acción de la fuerza electrostática existente entre las cargas debido a que hay ciertas órbitas estables en las que puede permanecer el electrón.