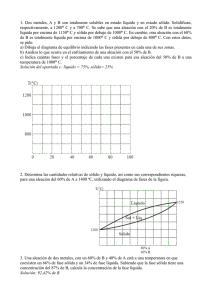
DIAGRAMA DE EQUILIBRIO DE ALEACIONES BINARIAS
Anuncio
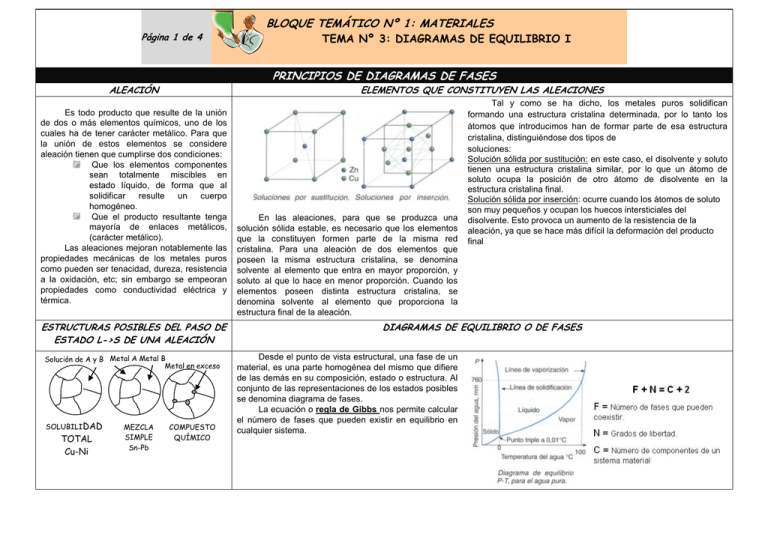
Página 1 de 4 ELEMENTOS QUE CONSTITUYEN LAS ALEACIONES Es todo producto que resulte de la unión de dos o más elementos químicos, uno de los cuales ha de tener carácter metálico. Para que la unión de estos elementos se considere aleación tienen que cumplirse dos condiciones: Que los elementos componentes sean totalmente miscibles en estado líquido, de forma que al solidificar resulte un cuerpo homogéneo. Que el producto resultante tenga mayoría de enlaces metálicos, (carácter metálico). Las aleaciones mejoran notablemente las propiedades mecánicas de los metales puros como pueden ser tenacidad, dureza, resistencia a la oxidación, etc; sin embargo se empeoran propiedades como conductividad eléctrica y térmica. ESTRUCTURAS POSIBLES DEL PASO DE ESTADO L->S DE UNA ALEACIÓN Solución de A y B Metal A Metal B Metal en exceso TOTAL Cu-Ni MEZCLA SIMPLE Sn-Pb TEMA Nº 3: DIAGRAMAS DE EQUILIBRIO I PRINCIPIOS DE DIAGRAMAS DE FASES ALEACIÓN SOLUBILIDAD BLOQUE TEMÁTICO Nº 1: MATERIALES COMPUESTO QUÍMICO En las aleaciones, para que se produzca una solución sólida estable, es necesario que los elementos que la constituyen formen parte de la misma red cristalina. Para una aleación de dos elementos que poseen la misma estructura cristalina, se denomina solvente al elemento que entra en mayor proporción, y soluto al que lo hace en menor proporción. Cuando los elementos poseen distinta estructura cristalina, se denomina solvente al elemento que proporciona la estructura final de la aleación. Tal y como se ha dicho, los metales puros solidifican formando una estructura cristalina determinada, por lo tanto los átomos que introducimos han de formar parte de esa estructura cristalina, distinguiéndose dos tipos de soluciones: Solución sólida por sustitución: en este caso, el disolvente y soluto tienen una estructura cristalina similar, por lo que un átomo de soluto ocupa la posición de otro átomo de disolvente en la estructura cristalina final. Solución sólida por inserción: ocurre cuando los átomos de soluto son muy pequeños y ocupan los huecos intersticiales del disolvente. Esto provoca un aumento de la resistencia de la aleación, ya que se hace más difícil la deformación del producto final DIAGRAMAS DE EQUILIBRIO O DE FASES Desde el punto de vista estructural, una fase de un material, es una parte homogénea del mismo que difiere de las demás en su composición, estado o estructura. Al conjunto de las representaciones de los estados posibles se denomina diagrama de fases. La ecuación o regla de Gibbs nos permite calcular el número de fases que pueden existir en equilibrio en cualquier sistema. DIAGRAMA DE EQUILIBRIO DE ALEACIONES BINARIAS Componentes de solubilidad total en estado sólido y líquido Componentes totalmente solubles en estado líquido e insolubles en estado sólido. L t 100%A 100%B Componentes totalmente solubles en estado líquido e insolubles en estado sólido, con formación de punto eutéctico. Componentes totalmente solubles en estado líquido y parcialmente solubles en estado sólido. III II I 100%B 100%A II I E 100%A 100%B II I II III L L E (A+B) B+E(A+B) Una aleación eutéctica se caracteriza por ser la de más bajo PF y porque funde a una temperatura cte, coloquialmente se dice que funde bien. Β Para facilitar el estudio de las aleaciones se recurre a una representación gráfica de las distintas dosificaciones de los componentes, relacionando los tiempos con las temperaturas críticas de las distintas aleaciones. Curva de solidificación o diagrama de enfriamiento de un metal puro (solidifica a una Tª cte) y de un a aleación (la Tª de solidificación es variable). A A Sol B+L α E + α Β +E DIAGRAMAS DE EQUILIBRIO O DE SOLIDIFICACIÓN T L+α Sol A+ L Β+L 100%B 100% El metal de más bajo PF solidifica a temperatura cte A cuando ha solidificado totalmente el metal A A+E(A+B) α Β+α La solidificación no se realiza a temperatura cte, sino que empieza por debajo del metal de más alto PF y termina por encima del metal de más bajo PF. E L+α L+α α I II I II E L 100%B L+α I I E 100%A 100%A L I 100%B I 100%A I 100%B T T Componentes totalmente solubles en estado líquido y parcialmente solubles en estado sólido, con formación de eutéctica. Β+α Θ1 Θ2 Θs B B C C D D LIMITE DE SATURACIÓN AB: período fase líquida. BC: solidificación CD: fase sólida t B: comienzo solidificación. Θs: Tª de solidificación metal puro Θ2: Tª final de solidificación. Θ1: Tª de comienzo solidificación aleación DIAGRAMA DE EQUILIBRIO DE ALEACIONES BINARIAS: Componentes de solubilidad total en estado sólido Componentes totalmente solubles en estado y líquido líquido e insolubles en estado sólido Componentes totalmente solubles en estado líquido e insolubles en estado sólido, con formación de punto eutéctico. C D A B E Espacio reservado para resolución: Espacio reservado para resolución rellenar la tabla para siguiente para cada uno de los ptos señalados por el profesor en el diagrama. PTO Tª Fase Concentración Cantidad PTO T ª Fase Concentración Cantidad Espacio reservado para resolución PTO A T ª Fase Concentración Cantidad α+L Cα = 100% A 0% B CL = 60% A 0% B A LA B α+L Cα = 100% A 0% B CL = 50% A 50% B 80 60 100 50% 100 60 100 80 100 50% 100 60 80 50 100 60% 100 50 100 80 100 40% 100 50 A LA C L 80% A 20% B 100% D α+L Cα = 100% A 0% B CL = 60% A 0% B A LA 80 60 100 50% 100 60 100 80 100 50% 100 60 Cuando un punto se encuentra en un estado bifásico en el que coexisten una fase sólida y otra líquida L. la composición química del sólido y líquido puede determinarse por la regla de la horizontal, trazando una horizontal que pase por el punto y que corte a las líneas de fase (solidus y liquidus) en cα y cL. Si llamamos wL al tanto por uno que tenemos de masa líquida en ese punto y w α al tanto por uno que tenemos de masa sólida en ese mismo punto, podemos determinar las masas mediante las siguientes ecuaciones, aplicando lo que se conoce como regla de la palanca. Co = concentración del elemento A o B en el punto de estudio. Si utilizamos concentraciones del elemento A, las ecuaciones correspondientes a wL y w α son: CL = concentración del líquido correspondiente al elemento A o B. Cα = concentración del sólido correspondiente al elemento A o B. co c L c c L L c c o c c L PROBLEMAS Espacio reservado para la resolución Problema Nº 1: En este ejercicio cada alumno o grupo de alumnos deberá escoger los datos convenientemente y resolverlo adecuadamente. Dos metales A y B, son totalmente solubles en estado líquido y en estado sólido. Solidifican a ______ y ______, respectivamente. Se sabe que una aleación con el _____ de A es totalmente líquida por encima de los ________ y sólida por debajo de ______. se pide: A. dibuje el diagrama de equilibrio indicando las fases presentes en cada una de sus zonas. B. Analice lo que ocurre en el enfriamiento de una aleación del _____% de A, desde ______ªC hasta la temperatura ambiente. C. Para la aleación anterior y la temperatura de ______ºC, ¿existe más de una fase?. Si la respuesta es afirmativa, ¿qué porcentaje hay de cada una?: (nota tomar los cortes con el diagrama en _____ y ______ para la resolución del ejercicio. Espacio reservado para la resolución Nota aclaratoria: como los diagramas están ya dibujados para que todos podamos obtener los mismos resultados en la resolución del problema, cada alumno deberá ir siguiendo las explicaciones del profesor de cómo se construyen dichos diagramas a partir de los datos dados, marcando sobre el mismo con un lápiz o bolígrafo. Problema Nº2 DIRECCIONES WEBS RECOMENDADAS http://portaleso.homelinux.com/portaleso/trabajos/tecnologia/materiales/diagr amas_de_equilibrio.swf PARA SABER MÁS