SEMANA1 - Instituto de Higiene
Anuncio

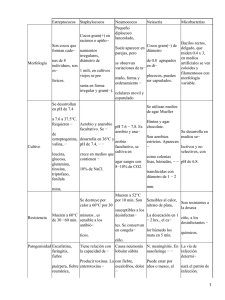
DEPARTAMENTO DE BACTERIOLOGIA Y VIROLOGIA CEFA 2010/UTI III OBJETIVOS Y CRONOGRAMA DIARIO DE LA SEMANA 1 TEMARIO: Relación huésped-parásito. Flora normal. Principales agentes de infección de piel y tejidos blandos *. Modelos: S. aureus y C. perfringens. *nota: Tomado del libro: Enfermedades Infecciosas, Mandell 2003; la traducción al español utiliza este termino en sustitución a partes blandas. OBJETIVOS 1. Objetivos generales Al finalizar la semana, el estudiante poseerá nociones respecto a la forma en que los principales agentes bacterianos causantes de infecciones de piel y tejidos blandos, participan en dichos procesos. Habrá avanzado en su capacidad de explicar como estos microorganismos causan infección, pudiendo describir las principales características biológicas y determinantes de patogenicidad de los modelos infecciosos planteados. 2. Objetivos específicos: Cumplida esta semana, el estudiante será capaz de: - Detallar los principales conceptos de bioseguridad en el laboratorio de microbiología, de manera de manejarse adecuadamente en el mismo. - Diferenciar cuales sitios anatómicos contienen flora y cuales son estériles. - Describir a grandes rasgos la composición de la flora normal en los diferentes sitios anatómicos diferenciando flora basal y flora transitoria. - Estudiar las distintas formas de interrelación entre parásito y huésped, definiendo los conceptos de portador, infección y enfermedad infecciosa. - Describir las principales características de las siguientes infecciones de piel y tejidos blandos: impétigo, erisipela, forúnculo, foliculitis, absceso, celulitis, mionecrosis. - Clasificar al género Staphylococcus, estimando su importancia en nuestra realidad médica. - Describir y analizar las principales características morfológicas, estructurales y biológicas de S. aureus. - Reconocer los principales grupos de antimicrobianos utilizados en el tratamiento de las infecciones estafilocóccicas. - Describir el concepto de susceptibilidad y de resistencia a antimicrobianos, aplicada a Staphylococcus. Definir los perfiles de resistencia de las distintas cepas de S. aureus. - Clasificar al género Clostridium estimando su importancia en nuestra realidad médica. - Describir y analizar las principales características morfológicas, estructurales y biológicas de C. perfringens. Definir esporulación. - Describir los procedimientos de estudio de estos microorganismos: toma de muestras, condiciones y medios de cultivo, pruebas de identificación a nivel de género y especie. 3. Objetivos de destrezas: - Diferenciar al microscopio óptico células eucariotas de procariotas. - Realizar la preparación de un frotis y su tinción con técnica de Gram. - Identificar al microscopio óptico bacterias Gram Positivas y diferenciar morfológicamente cocos de bacilos. - Realizar el estudio de sensibilidad antibiótica por el método de disco difusión en agar (antibiograma) y poder interpretarlo utilizando las tablas estándares. 1 CRONOGRAMA Lunes 5/04. Bioseguridad en el laboratorio. Relación huésped-parásito, Flora normal. Bioseguridad en el laboratorio para el correcto manejo en clase. Flora normal de piel y mucosas. Flora basal y transitoria. Conceptos de portador, infección y enfermedad infecciosa. Conceptos de siembra y aislamiento. Práctico: - Realización de frotis de mucosas y tinción por Gram. - Observación microscópica de los frotis realizados y teñidos. - Observación microscópica de un frotis proveniente de un exudado vaginal normal. - Toma de muestras y siembra de hisopados de superficies cutáneo-mucosas. - Viñeta clínica de muestra "A" y siembra de la muestra clínica (hisopado de una lesión de piel), en agar sangre y agar simple. Se propone trabajar en 4 subgrupos, 1 procesa la muestra A y los otros 3 realizan frotis y siembra de hisopados de superficies cutáneo - mucosas. Monitor: -Pautas para discutir normas de bioseguridad en el laboratorio. -Flora normal: Frotis de exudado vaginal (células epiteliales y lactobacilos) Placa de agar sangre con exudado faríngeo, exudado nasal y piel; Observación microscópica de las colonias correspondientes (cocos Gram positivos en cadenas, cocos Gram positivos en racimos, cocos y bacilos Gram positivos). Martes 6/04. Microorganismos asociados a infecciones de piel y partes blandas. Modelo de estudio: Staphylococcus aureus. Morfología y estructura de Staphylococcus sp. Introducir conceptos de requerimientos nutricionales y medios de cultivo. Concepto de cultivo puro. Practico: - Evaluación macro y microscópica de los cultivos del día anterior de superficies cutáneo mucosas (observar las placas, describir los distintos tipos de colonias y realizar Gram). - Evaluación macro y microscópica de la siembra y aislamiento realizado a la muestra A; se observará un cultivo puro de S. aureus. Ver requerimientos nutricionales. Iniciar sistemática de identificación de S. aureus. Realizar prueba de catalasa, clumping factor (coagulasa en lámina) y DNAsa. - Se analizará la viñeta “B”. Se llevará al salón muestra B ya sembrada en agar sangre y agar simple, se le realizará también: prueba de catalasa, clumping factor y DNAsa. Monitor: - Diferentes morfologías coloniales. - Alfa y beta hemólisis en agar sangre. - Aislamiento de S. aureus y frotis de estas colonias al Gram. - Pus con S. aureus. - Esquema de la estructura de la pared bacteriana y de la pared Gram positiva. 2 Miércoles 7/04. Staphylococcus: patogenicidad, métodos de estudio, sensibilidad a antibióticos. Principales factores de virulencia y patogenicidad de S. aureus. Practico: - Identificación presuntiva de Staphylococcus. - Introducción al estudio de la sensibilidad a antimicrobianos. Realización de antibiogramas a las cepas de las muestras A y B. Monitor Catalasa, clumping factor, DNAsa. Antibiograma Fotografías de 3 situaciones clínicas de las que surgieron 3 cepas de S. aureus: infección de tejidos blandos, impétigo, forúnculo. Examen microscópico directo de procesos por S. aureus (cocos Gram positivos y células polimorfonucleares). Jueves 08/04. Identificación de S. aureus. Antibiograma. Practico: - Lectura e interpretación de los antibiogramas sembrados el día anterior. - Describir los 3 patrones más importantes de resistencia de S. aureus (sensible, SAMR-com, SAMR hospitalario). Viernes 09/04. Anaerobios e infecciones de piel y tejidos blandos. Modelo: Clostridium perfringens. - Observación microscópica de frotis realizados a partir de colonias crecidas en placas de agar sangre incubadas en anaerobiosis. Las mismas desarrollaron a partir de la siembra de muestra "C", procesada por nosotros. - Observación de medio tioglicolato para discusión de requerimientos atmosféricos - Principales factores de virulencia y mecanismos de patogenicidad de C. perfringens. - Concepto de esporulación. Monitor: Jarra de anaerobiosis. Cultivo en agar sangre de C. perfringens. Examen microscópico directo de procesos por C. perfringens. Frotis al gram de C. perfringens. Foto de lesión asociada a anaerobios (gangrena). Examen directo de infección polimicrobiana. Esquema de esporulación. Frotis al Gram de C. dificcile y C. tetani (esporos). Coloración de verde de malaquita para observación de esporos. 3 VIÑETAS CLÍNICAS CORRESPONDIENTES A LAS MUESTRAS QUE SERÁN ESTUDIADAS EN LA SEMANA 1. Niño de 2 años, Consulta por lesiones de piel en diferentes áreas del cuerpo y en distintos estadios evolutivos; algunas máculas, vesículas y lesiones costrosas con reacción inflamatoria perilesional. Las lesiones están ubicadas principalmente a nivel de surco nasogeniano derecho (con extensión a fosa nasal derecha) y en extremidades superiores e inferiores. A nivel intranasal la lesión es costrosa. Sin fiebre y sin otra sintomatología. Se realiza un exudado de lesión ubicada en el surco nasogeniano, con hisopo estéril, y se envía al laboratorio para su estudio (muestra "A"). Varón de 18 años sin antecedentes patológicos a destacar. Hace 4 días recibe medicación intramuscular a nivel de glúteo derecho por contractura muscular. El día de ayer comienza con dolor en dicha región, por lo cual consulta, no presenta fiebre ni otra sintomatología a destacar. Al examen físico el paciente se presenta apirético, con buen estado general. Se constata en glúteo derecho, tumefacción de 3 cm de diámetro eritematosa, caliente y fluctuante. Se punciona dicha tumefacción con jeringa y se extrae secreción mucopurulenta que se envía al laboratorio para su estudio (muestra "B"). Paciente de 45 años que ingresa hace 5 días al Instituto de Traumatología por fractura expuesta de tibia derecha por accidente de moto; se realiza cirugía. A los 2 días comienza con dolor en MID. Al examen se observan fijadores externos y amplias suturas de colgajos, con tejido necrótico, áreas fluxivas y escasa supuración; a la palpación crepitación. Ingresa a block quirúgico para debridación y se envía al laboratorio muestra de tejido en caldo Tioglicolato muestra "C". Se siembra en agar sangre y se incuba en anaerobiosis. Se obtiene el cultivo que ud. observa. 4