Espectrometria de masas. BVII
Anuncio

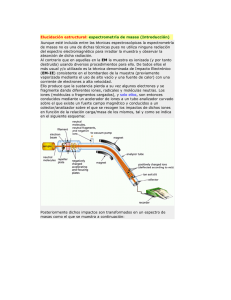
Equipamiento del alta complejidad - Espectrómetro de masas Módulo II ESPECTROMETRÍA DE MASAS Docente: Dr. Ing. Sergio Alemano Dirección: Dpto. de Ciencias Naturales. Universidad Nacional de Río Cuarto. Campus Universitario. Correo electrónico: [email protected] Objetivos Comprender los fundamentos de la espectrometría de masas. Introducción La espectrometría de masas es una técnica para identificar y cuantificar compuestos, básicamente consiste en un flujo de electrones que impacta ante un haz de moléculas ionizándolas y fragmentándolas. De ello resulta una mezcla de iones cargados que pueden ser acelerados cuando atraviesan un campo magnético, alcanzando velocidades que pueden alcanzar casi los 100 Km. h-1. Esta técnica es destructiva de la muestra, al ser ionizada y fragmentada las moléculas, tal patrón de fragmentación se caracteriza por ser único para cada compuesto y se puede emplear como “huella digital” química para caracterizar al analito, ello a partir de picomoles de muestra. Básicamente un espectrómetro de masas cuenta con: Fig. Nº 1.- Componentes básicos de un espectrómetro de masas Equipamiento del alta complejidad - Espectrómetro de masas Módulo II Fuente de iones Entonces, lo primero que necesitamos es generar moléculas ionizadas, a partir de lo cual cada una de ellas poseerá una relación masa / carga (m/z) característica. La formación de iones de la muestra en fase gaseosa era una pre-requisito esencial para la formación de iones, nuevos desarrollos han permitido obtenerla a partir de soluciones líquidas ó matrices sólidas. Cuando se desea obtener la identificación y-ó cuantificación de uno ó más compuestos que se encuentran en una mezcla, como puede suceder cuando evaluó un compuesto natural, (vegetal, animal, humano, etc.), previamente debo separar lo mejor posible los compuestos individuales, para lo cual antes de entrar a un espectrómetro de masas, las muestras deben pasar por un cromatógrafo gaseoso (CG) o por un cromatógrafo liquido de alta presión (HPLC), de utra presión (UPLC), ó por electroforesis capilar entre otros. Las fuentes de ionización tradicionales estaban asociadas a cromatógrafos gaseosos donde las moléculas tenían que soportar altas temperaturas y debían ser volátiles, lo cual no es una propiedad de muchas moléculas orgánicas, por lo cual había que modificarlas químicamente por derivatización, lo cual es bastante engorroso. Dentro de este tipo de ionizaciones encontramos las generadas por Impacto electrónico, donde los electrones son generados por emisión térmica de un filamento caliente, utilizándose en forma estandarizada un flujo de electrones de 70 eV (electrón volt), proceso que por lo general causa una muy importante fragmentación de las moléculas que complica la identificación de las mismas. Otra forma de ionización pero más suave (produce menos fragmentación), es mediante la Ionización química, en la cual se generan iones que afectan al compuesto los cuales provienen de la ionización por impacto electrónico sobre agentes gaseosos como metano, isobutano y amoniaco, formando iones CH+5; C4H+9 y NH+4. Recientemente, se han desarrollado métodos de ionización a presión atmosférica (API), entre los que encontramos el método de ionización por Electrospray (ESI), el cual consiste que se forma un microspray líquido en un capilar o aguja en la punta de la cual se aplica un potencial de 3-4 kV (Fig. 2), ocurriendo procesos físicos que permiten tener microgotas cargadas eléctricamente que se van reduciendo hasta que finalmente contendrán una sola molécula cargada (Fig. 3). Fig. Nº 2.- Fuente de ionización de electroespray Equipamiento del alta complejidad - Espectrómetro de masas Módulo II Esta determinación le valió al estadounidense John Fenn el premio Nobel de Química en 2002, que compartió con el japonés Koichi Tanaka y el suizo Kurt Wüthrich, por el desarrollo de métodos de identificación y análisis estructural de macromoléculas biológicas. Fig. Nº 3.- Diagrama de la fuente de ionización de electroespray En este tipo de ionización es fundamental poder sacar los restos de solventes, para lo cual se usa temperatura y nitrógeno líquido para su secado. Este tipo de ionización tiene la ventaja además que se la pueda acoplar a un HPLC ó UPLC. Otra técnica de ionización desarrollada en los años 80s, es cuando los analitos son disueltos en una solución de un compuesto se va secando y cristalizando en una matriz y luego mediante pulsos de láser se va evaporando los iones de los analitos y son llevados a la fase gaseosa, siendo la ionización generada por el ambiente ácido producido por los compuestos de la matriz, tal método de ionización es conocida como Ionización – deserción de matriz asistida por láser (MALDI) (Fig. 4). Fig. Nº 4.- Diagrama de la fuente de ionización de Ionización–deserción de matriz asistida por láser Equipamiento del alta complejidad - Espectrómetro de masas Módulo II Esta forma de ionización es muy utilizada para la ionización de biomoléculas (proteínas, péptidos y azucares). Analizadores de iones Cuando se forman los iones, podemos encontrar al ion molecular, que es el peso molecular de la molécula en evaluación la cual posee una masa (m) correspondiente al peso molecular de la misma en su forma ionizada (z), por lo cual posee una relación m/z característica. Por otra parte, se van a generar fragmento de estas moléculas, las cuales tendrán otras relaciones m/z. A partir de ello, es necesario contar con un analizador que pueda determinar la abundancia de cada una de las relaciones m/z, a partir del rango y resolución que tengan los analizadores, lo encontramos de distintas estructuras y costos. Dentro de ellos encontramos, a los espectrómetros de masas de sector magnético (Magnetic Sector Mass Spectrometer), donde los iones atraviesan una zona curvada donde se encuentra un imán, y adoptan diferentes trayectorias parabólicas de acuerdo a su masa (Fig. Nº 5), por lo cual variando el campo magnético desde el imán, puedo separar las distintas masas y su abundancia iónica. El radio de curvatura exacto de la trayectoria de un ión depende de la relación masa-carga, simbolizada por m/z. Los iones circulan a través de un ambiente con un alto vacío, que tiene como finalidad evitar que generen reacciones con otras partículas, siendo las presiones necesarias de 10-5 a 10-8 Torr. . Fig. Nº 5.- Diagrama de un espectrómetro de masas de sector magnético Este tipo de analizadores fueron los primeros desarrollados, siendo el origen de los espectrómetros de masas en los experimentos desarrollados en la Universidad de Cambridge en Inglaterra en 1897 por Joseph John Thomson, que hizo el primer espectrómetro de masas (Fig. Nº 6) Equipamiento del alta complejidad - Espectrómetro de masas Módulo II Fig. Nº 6.- Parábola espectrográfica construida por J.J. Thomson En la década de los 40´s, aparecen los primeros espectrómetros de masas disponibles comercialmente por compañías de Europa y USA, los mismos eran del tipo de Espectrómetro de masas de sector magnético (Magnetic Sector Mass Spectrometer) A principios de los 50´s, los patrones de fragmentación de los iones comenzaron a ser entendidos, aunque los aparatos disponibles estaban limitados en el rango de masas. En 1953 el analizador de masas cuadrupolo fue patentado por Wolfgang Paul de la Universidad de Bonn, el cual consiste en cuatro rodillos paralelos a los que se aplica una corriente continua (DC) sobre la que se superpone un potencial de radiofrecuencia (RF). El campo creado en los rodillos actúa a modo de filtro y determina que iones alcanzarán el detector (Fig. Nº 7). Los iones, en esta región de campo variable, oscilarán dependiendo del campo de radiofrecuencia aplicado así como de su relación m/z, por lo que solo determinados iones alcanzaran el detector. De este modo, un espectro de masas se conseguirá barriendo (scanning) el campo RF dentro de un rango de frecuencias. Fig. Nº 5.- Analizador de iones por cuadripolo Equipamiento del alta complejidad - Espectrómetro de masas Módulo II El analizador de cuádruplo es uno de los más extendidos hoy día debido a su relativa sencillez que se une una alta tolerancia a vacíos relativamente pobres, rango de masas de hasta 3000 Da que lo hace muy adecuado para ser acoplado a interfases de cualquier tipo, incluida la ESI, para el análisis de proteínas y biomoléculas y lo que es mas importante, su relativo bajo costo. Su principal desventaja es la imposibilidad de realizar análisis de alta resolución, masas exactas, etc., así como su limitación en cuanto a rango de masas. En 1956 las primeras muestras biológicas (esteroides) fueron exitosamente analizadas En los 80’, Wolfgang Paul de la Universidad de Bonn, obtiene el Premio Nobel de Física en 1989 por su trabajo de trampa de iones (ion trapping). Al igual que los cuadrupolos, utilizan campos eléctricos oscilantes para atrapar a los iones en forma controlada, para lo cual los iones son atrapados en un espacio tridimensional, lo cual se logra con un electrodo circular y dos electrodos hiperbólicos en los extremos y se generan campos eléctricos oscilantes (Fig. Nº 8). Durante el proceso de detección, los potenciales de los electrodos son alterados para producir una rampa de amplitud de radio frecuencia en las trayectorias de los iones y así expulsar los iones en dirección axial. Los iones son expulsados en orden de decrementos de m/z, enfocados a la salida de la trampa y detectados por el sistema de detección de iones. Este sistema posee alta sensibilidad además de ser equipos relativamente compactos, pero ofrecen poca capacidad en análisis cuantitativos, pueden sufrir de efectos por cargas y reacciones de los iones, muchos parámetros influyen la calidad del espectro obtenido por este método (excitación, atrapado y detección de los iones) por lo que debe contarse con sistemas de control sumamente precisos. Fig. Nº 8.- Analizador de iones por trampa de iones Otro analizador de iones es el correspondiente al tiempo de vuelo (Time of flight TOF), el cual consiste en medir el tiempo que tarda un ión con una energía de aceleración de 3000 eV para recorrer el espacio para viajar desde la fuente de iones hasta el detector localizado a 1-2 metros (Fig. Nº 9). Tal tiempo va a depender de la relación m/z de los iones a evaluar. Equipamiento del alta complejidad - Espectrómetro de masas Módulo II Fig. Nº 9.- Fundamentos y analizador de iones por tiempo de vuelo El analizador TOF es rápido y puede adaptarse a los métodos de ionización por pulsos (MALDI), tiene alta transmisión de iones y el rango de masas más grande de todos los analizadores de masas, por ello son utilizados en la determinación de proteínas y péptidos. Algunas limitantes son que en muchas ocasiones requieren exclusivamente de un método de ionización por pulsos y que la selectividad de los iones puede limitarse en algunos experimentos Multiplicación y detección de iones Las propiedades que se deben tener en cuenta son sensibilidad, precisión y tiempo de respuesta. Entre las más utilizadas encontramos el multiplicador de electrones (Fig. Nº 10), ello a partir de que son confiables, baratos y capturan casi todos lo electrones. Básicamente los electrones son capturados por un centellador (pantalla de fosforo) y son enviados al canal multiplicador de electrones. Este cono en forma de cuerno tiene aplicado un alto voltaje, y es opuesto al ion que está siendo detectado. Los iones son atraídos hacia el cono y luego cuando chocan en las superficies del mismo donde se emiten electrones secundarios y luego el proceso continúa con la emisión de nuevos electrones provenientes de más choques sobre la superficie del cuerno, formándose una cascada de electrones (Fig Nº 11) llegando a ganancias de señal de 106-108. Equipamiento del alta complejidad - Espectrómetro de masas Módulo II Fig. Nº 10.- Canal multiplicador de electrones Fig. Nº 11.- Cascada de electrones en el canal multiplicador de electrones Adquisición, procesamiento y presentación de datos La señal que finalmente será remitida desde el detector a la CPU, será una señal voltaica que después será transformada en formato digital y posteriormente procesada. Básicamente el software a utilizar consiste en logaritmos que le debemos dar los parámetros adecuados, lo cual se logra a través de una adecuada calibración del espectro de masas con compuestos conocidos, y se debe tener cuidado de que tal calibración se realice dentro de los rangos de trabajo. El software deberá discriminar los diferentes picos, que va a ser la intensidad con que aparece una determinada molécula ó su fragmento, que tendrá una relación m/z particular, por lo que también es de importancia definir la relación señal/ruido a partir de la cual consideramos un pico. Debemos tener presente que los equipos modernos producen una gran cantidad de señales entre las que se encontraran tanto las de nuestro interés, como aquella a la cual simplemente podemos considerar ruido y que proviene de columnas, solventes y fondo que posee la muestra a analizar. Equipamiento del alta complejidad - Espectrómetro de masas Módulo II Fig. Nº 13.- Espectro de masas típico Una vez definido el pico sale el fragmento ó molécula de mi interés, puedo ver como está constituido su espectro. Los datos del espectro se presentan según lo que indica la Fig. (Nº 12), donde se grafica la abundancia relativa de fragmentos ionizados y la relación m/z. Allí podemos identificar un Ion Molecular, que es el peso molecular de la molécula original sin fragmentar e ionizada y el pico base, que se lo define al pico que corresponde con la m/z con la mayor frecuencia relativa (100 %). Por otra parte se pueden ir identificando los distintos fragmentos y sus relaciones m/z características, teniendo cada compuesto iones específicos deacuerdo a su estructura química. Los modo de medición con un solo analizador pueden ser: realizando una rastreo de un rango de masas (SCAN) ó eligiendo un m/z determinado y solamente ese ión dejarlo pasar por el analizador (SIM) (Fig. N 12). Fig. Nº 14.- Modos de medición SCAN y SIM Equipamiento del alta complejidad - Espectrómetro de masas Módulo II La cuantificación se realizará a partir de las áreas que generarán cada una de las moléculas ó fragmentos en un cromatograma, en el cual aparecerá en un tiempo relativo (RT) para cada compuesto (Fig, 15), los que serán generado deacuerdo al método cromatográfico utilizado, y tales áreas serán asociadas a las áreas generadas por diferentes concentraciones del compuesto patrón. Fig. Nº 15.- Cromatograma y espectro de masas Espectrometría de masas en tándem Un equipo de MS/MS está constituido de seis componentes básicos: 1) sistema de introducción de muestra; 2) fuente de ionización; 3) primer analizador de masas (MS1); 4) cámara o celda de colisión; 5) segundo analizador de masas (MS2); 6) detector. La técnica usualmente se abrevia como: tándem MS, MS/MS, MS2, QqQ (en el caso de los equipos triple cuádruplo) Las combinatorias a poder realizarse se puede observar en la Fig. Nº 16. Fig. Nº 16.- Esquema de sistemas MS/MS Equipamiento del alta complejidad - Espectrómetro de masas Módulo II Bibliografía 1.- Fernández-Lainez, Cynthia, Marcela Vela-Amieva, M. en C. Isabel Ibarra-González 2009. Espectrometría de masas en tándem: una nueva herramienta para el estudio de la metabolómica en pediatría Acta Pediatr Mex ;30(5):258-63 2.-Worley por Jenna y Steve Kvech. ICP-MS. http://www.cee.vt.edu/ewr/ environmental/teach/smprimer/icpms/icpms.htm (lectura 09.09.2010) 3.-Secondary Ion Mass Spectrometry Instrumentation http://pprco.tripod.com/SIMS/Instrumentation.htm (lectura 09.09.2010) Tutorial. 4.- Mass Spectrometry 101. An Introductory Lecture On Mass Spectrometry Fundamentals Presented to the Sandler Mass Spectrometry Users’ Group University of California San Francisco. April 11, 2003 5.-Villa, Germán Plascencia. 2003 Espectrometría de masas. Curso de métodos. Maestría en Ciencias Bioquímicas. Instituto de Biotecnología. Universidad Nacional Autónoma de México. Cuernavaca, Morelos. 6.- Rodriguez, José. Seminario de Espectrometría de masas para usuarios del SUIC. Agilent Technologies. 7.- Ardanaz, Carlos. 2010. Curso de postgrado sobre Hormonas Vegetales: Características, su identificación y cuantificación por espectrometría de masas. Apuntes de clases.