Teoria del campo cristalino
Anuncio

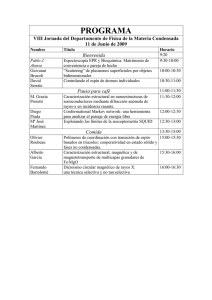
Curso de Química Inorgánica II Escuela de Ciencias Químicas Facultad de Ciencias UPTC PhD. Jovanny Arlés Gómez Castaño Introducción Los complejos de los metales d desempeñan un papel importante en la química inorgánica. En este curso centraremos nuestra atención en el estudio de: 1. La naturaleza del enlace ligante-metal en términos de dos modelos teóricos: Teoría de campo cristalino (modelo electrostático, simple) Teoría del campo de los ligante (teoría de los OM, sofisticado) (En ambas teorías se usa un parámetro, el del desdoblamiento del campo de los ligantes, para correlacionar las propiedades espectroscópicas y magnéticas de los complejos). 2. El análisis de las energías y las intensidades de las transiciones de los espectros electrónicos de los complejos en términos de la teoría del campo de los ligantes. Teoría de campo cristalino En la teoría de campo cristalino el par de electrones sin compartir de un ligante se considera una carga puntual negativa que repele a los electrones que están en los orbitales d del ion metálico central. El objeto de estudio de esta teoría es el desdoblamiento de los orbitales d en conjuntos con diferentes energías y el uso que se le da a este desdoblamiento resultante para racionalizar y correlacionar en base a él los espectros ópticos, la estabilidad termodinámica y las propiedades magnéticas de los complejos. (Los complejos tetraédricos y octaédricos son los más importantes, así que comenzaremos por ellos). Teoría de campo cristalino a) Complejos octaédricos Punto clave: en la presencia de un campo cristalino octaédrico, los orbitales d se desdoblan en un conjunto de tres orbitales degenerados de menor energía (t2g) y un conjunto de dos orbitales degenerados de mayor energía (eg) separados entre sí por una diferencia de energía O; el parámetro de desdoblamiento del campo de los ligantes aumenta a lo largo de la serie espectroquímica de los ligantes y varía con la identidad y la carga del átomo metálico. Orientación de los cinco orbitales d con respecto a los ligantes en un complejo octaédrico Teoría de campo cristalino a) Complejos octaédricos Los electrones en los orbitales dz2 y dx2-y2 (ambos de simetría eg en una geometría Oh) estan situados cerca de los ligantes, sobre los ejes, mientras que los electrones que se hayan en los orbitales dxy, dyz y dzx (de simetría t2g) están concentrados entre los ligantes. Como resultado, los primeros son repelidos más fuertemente por las cargas negativas de los ligantes que los últimos y por ello poseen una mayor energía. Este simple modelo conduce a un diagrama de niveles de energía en el cual el grupo triplemente degenerado de orbitales t2g queda con menor energía que el grupo doblemente degenerado de orbitales eg. Energías relativas de los orbitales d en un campo cristalino octaédrico Teoría de campo cristalino a) Complejos octaédricos La separación entre ambos conjuntos de orbitales se denomina parámetro de desdoblamiento del campo de los ligantes, O (donde el subíndice O indica que el campo cristalino es octaédrico). El nivel de energía que corresponde a un ambiente esférico y simétrico (donde las cargas negativas atribuidas a los ligantes se distribuyen uniformemente a lo largo de una esfera en lugar de estar localizadas en seis posiciones) se define como el baricentro del arreglo de los niveles energéticos. Los orbitales eg quedan a 3/5 O arriba del baricentro, mientras que los tres orbitales t2g quedan a 2/5 O debajo de el. Energías relativas de los orbitales d en un campo cristalino octaédrico Teoría de campo cristalino a) Complejos octaédricos Ejemplo: la más simple de las propiedades que se puede interpretar mediante la teoría de campo cristalino es el espectro electrónico de un complejo de un solo electrón, como es el caso del espectro de absorción óptica del ión d1 hexaacuatitanio (III), [Ti(OH2)6]3+. La teoría de campo cristalino asigna el primer máximo de absorción que aparece a 20300 cm-1 (493 nm) a la transición egt2g (estado de menor energía a la derecha) e identifica dicho valor (20300 cm-1) con el valor O del complejo . Teoría de campo cristalino a) Complejos octaédricos Es más complicado obtener valores de O para complejos con más de un electrón d, porque la energía de una transición depende no solamente de las energías de los orbitales, sino también de las energías de repulsión electrón-electrón. Este aspecto se trata con mayor detalle en una sección posterior. Los valores de desdoblamiento del campo de ligantes O mostrados en la tabla se han obtenido teniendo en cuenta la repulsión electrón - electrón. Teoría de campo cristalino a) Complejos octaédricos El parámetro de desdoblamiento del campo de los ligantes O varía de modo sistemático con la identidad del ligante. Por ejemplo, en la serie de complejos [CoX(NH3)5]n+ con X = I-, Br-, Cl-, H2O y NH3, los colores varían desde el púrpura (para X = I-), pasando por el rosa (para Cl-), siguiendo hasta el amarillo (con NH3). Esta observación indica que el valor de energía de la transición electrónica de menro contenido energético (y, por lo tanto, de O) se incrementa conforme los ligantes varían a lo largo de la serie. De hecho, sin importar la identidad del ión metálico, siempre se observa este orden. Con base en estas observaciones, Ryutaro Tsuchida propuso que los ligantes se pueden ordenar en una serie espectroquímica, en la que los miembros se encuentran dispuestos en orden creciente de energía de las transiciones que se producen cuando están presentes en un complejo (en los ligantes ambidentados, se subraya el átomo donador): I- Br- S2- SCN- Cl- NO2- N3- F- OH- C2O42- H2O NCS- CH3CN py NH3 en bipy phen NO2- PPh3 CN- CO Teoría de campo cristalino a) Complejos octaédricos Un ligante que da origen a una energía de transición alta (como el CO) se llama ligante de campo alto (o fuerte), mientras que uno que produce una energía de transición baja (como el Br-) se denomina ligante de campo bajo (o débil). Por sí sola, la teoría de campo cristalino no puede explicar esta tendencia, pero la teoría de campo de los ligantes sí, como se verá en una sección posterior. La fortaleza del campo de los ligantes también depende de la identidad del ión metálico central, siendo el orden aproximado: Mn2+ Ni2+ Co2+ Fe2+ V2+ Fe3+ Co3+ Mo3+ Rh3+ Ru3+ Pd4+ Ir3+ Pt4+ Teoría de campo cristalino a) Complejos octaédricos Observe que el valor de O aumenta conforme aumenta el número de oxidación del ión metálico central y también al descender en un grupo. La variación con el número de oxidación refleja el menor tamaño de los iones que tienen mayor carga, lo cual origina que las distancias metal-ligante sean más cortas y las energías de interacción resulten más altas. El aumento al bajar en un grupo refleja el mayor tamaño de los orbitales 4d y 5d comparados con los orbitales 3d, que son más compactos, y las consecuentes interacciones más fuertes con los ligantes. Mn2+ Ni2+ Co2+ Fe2+ V2+ Fe3+ Co3+ Mo3+ Rh3+ Ru3+ Pd4+ Ir3+ Pt4+ Teoría de campo cristalino b) Energías de estabilización del campo de los ligantes Punto clave: la energía de estabilización del campo de los ligantes es una medida de la energía neta de ocupación de los orbitales d respecto a su energía promedio. En un ión octaédrico la energía de un orbital t2g es -0,4 O relativa al baricentro, y la de un orbital eg es +0,6 O. La energía neta de una configuración t2gxegy, relativa al baricentro, la cual se denomina energía de estabilización del campo de los ligantes (EECL), es: EECL = (0,4x – 0,6y)O En la tabla siguiente se listan los valores de EECL para diversas configuraciones. La EECL es , generalmente, una fracción pequeña de la interacción total entre el átomo metálico y los ligantes y aumenta de izquierda a derecha a lo largo de un periodo debido a la disminución del radio de los iones M2+ a lo largo de las series. Teoría de campo cristalino b) Energías de estabilización del campo de los ligantes Teoría de campo cristalino c) Límites de campo bajo y campo alto Punto clave: la configuración de un complejo en su estado basal refleja los valores relativos del parámetro de desdoblamiento del campo de los ligantes y de la energía de apareamiento; para las especies 3dn con n = 4-7 se pueden formar complejos de alto espín y de bajo espín en el caso de campo bajo y campo alto, respectivamente. Los complejos de los metales de las series 4d y 5d son, típicamente, de bajo espín. Para obtener las configuraciones de los complejos de los metales d en su estado basal, se utiliza el diagrama de niveles de energía de los orbitales d que se muestra en la figura como una base para aplicar el principio de construcción progresiva. La configuración de menor energía no debe violar el principio de exclusión de Pauli y (si está disponible más de un orbital degenerado) debe cumplir también con el requerimiento de que los electrones ocupen primero orbitales separados y que lo hagan con espines paralelos. Teoría de campo cristalino c) Límites de campo bajo y campo alto Complejos que forman los elementos de la serie 3d En un complejo octaédrico, los primeros tres electrones d de un complejo 3dn ocupan orbitales separados de no enlace t2g y lo hacen con espines paralelos. Por ejemplo, los iones Ti2+ y V2+ tienen una configuración electrónica 3d2 y 3d3, respectivmente; los electrones d ocupan orbitales t2g de menor energía, como se muestra en (1) y (2), respectivamente. De esta manera los complejos están estabilizados por 2 x (0,4O) = 0,8O para Ti2+ y 3 x(0,4 O) = 1,2 O para V2+. Teoría de campo cristalino c) Límites de campo bajo y campo alto Complejos que forman los elementos de la serie 3d El siguiente electrón, necesario para iones 3d4 como el Cr2+, puede ingresar en uno de los orbitales t2g y aparearse con el electrón ya presente (3); sin embargo, si esto pasa, el electrón que ingresa experimentará una fuerte repulsión culómbica denominada energía de apareamiento, P. Como alternativa, el electrón que ingresa puede hacerlo en uno de los orbitales eg (4). Aunque con ello evita la energía de apareamiento, este orbital tiene mayor energía en O. En el primer caso, (t42g), la EECL es de 1,6 O, la energía de apareamiento es P y la estabilización global 1,6 O – P. En el segundo caso (t32ge1g), la EECL es 3 x (0,4 O) – 0,6 O, y no hay que considerar la energía de apareamiento. La configuración que se adopta depende de cuál de los dos valores, 1,6 O- P ó 0,6 O sea mayor. Teoría de campo cristalino c) Límites de campo bajo y campo alto Complejos que forman los elementos de la serie 3d Si O P, que se denomina caso de campo bajo, se alcanzará una menor energía si se ocupa el orbital superior, con lo que se obtiene la configuración t32ge1g. Si O P, lo que se conoce como caso de campo alto, se establecerá una menor energía si se ocupan los orbitales de menor energía, a pesar de costo energético del apareamiento. La configuración resultante es ahora t42g. Por ejemplo, la configuración del [Cr(OH2)6]2+ en su estado basal es t32ge1g , mientras que la del [Cr(CN)6]4-, cuyos ligantes son relativamente de campo alto, es t42g. Teoría de campo cristalino c) Límites de campo bajo y campo alto Complejos que forman los elementos de la serie 3d Hay dos configuraciones posibles para los complejos 3dn para n = 4 ó 5; en el caso del campo alto los orbitales más bajos se llenarán y darán origen a configuraciones tn2g , mientras que en el caso del campo bajo los electrones evitarán la energía de apareamiento, ocuparán los orbitales más altos y darán origen a configuraciones t32ge1g y t32ge2g. Debido a que en el último caso los electrones ocupan diferentes orbitales, tendrán espines paralelos. Cuando es posible establecer configuraciones alternativas, la especie que tenga menor número de espines electrónicos paralelos recibe el nombre de complejo de bajos espín, mientras que la especie que tenga mayor número de electrones con espines paralelos se llama complejo de alto espín. Teoría de campo cristalino c) Límites de campo bajo y campo alto Complejos que forman los elementos de la serie 3d Es más probable que un complejo octaédrico 3d4 sea de bajo espín, si el campo de los ligantes es alto, pero será de alto espín si el campo es bajo. Esto mismo se aplica para los complejos 3d5. Efecto de ligantes de campo bajo y fuerte en la ocupación de los electrones de un complejo d4. El primero da lugar a una configuración de alto espín y el segundo a una de bajo espín. Teoría de campo cristalino c) Límites de campo bajo y campo alto Complejos que forman los elementos de la serie 3d También se pueden encontrar configuraciones de alto y bajo espín para complejos 3d6 y 3d7. En estos casos, en un campo cristalino alto se generarán las configuraciones de bajo espín t62g (sin electrones desapareados) y t62ge1g (con un electrón desapareado), respectivamente, mientras que en un campo cristalino bajo se presentan las configuraciones de alto espín t42ge2g (con cuatro electrones desapareados) y t52ge2g (con tres electrones desapareados), respectivamente. Teoría de campo cristalino c) Límites de campo bajo y campo alto la intensidad del campo cristalino (como una medida del valor de O) y la energía de apareamiento de espines (medida por P) dependen de la identidad del metal y del ligante; así, no es posible especificar un punto en la serie espectroquímica en el que el complejo cambie de alto a bajo espín. Para los iones metálicos 3d, los complejos de bajo espín se generan por lo general con ligantes que ocupan un lugar alto en la serie espectroquímica (como el CN-), mientras que los complejos de alto espín son comunes para ligantes que ocupan un lugar bajo en la serie (como el F-). Para los complejos octaédricos dn con n = 1-3 y 8-10 no existe una ambigüedad en la configuración, así que no se utilizan los términos alto espín y bajo espín. Teoría de campo cristalino c) Límites de campo bajo y campo alto Como se ha visto, los valores de O de los complejos de los metales 4d y 5d son típicamente más altos que los de los metales 3d. En consecuencia, los complejos de estos metales suelen tener configuraciones electrónicas que son características de un campo cristalino fuerte, y típicamente son de bajo espín. Un ejemplo es el complejo 4d4 [RuCl6]2-, que posee una configuración t42g, correspondiente con un campo cristalino fuerte, aun cuando el Cl- ocupa un lugar bajo en la serie espectroquímica. De igual manera, [Ru(ox)3]3- tiene una configuración de bajo espín t52g, mientras que el [Fe(ox)3]3- tiene una de alto espín t32ge2g. Teoría de campo cristalino d) Mediciones magnéticas Punto clave: se pueden realizar mediciones magnéticas para determinar el número de espines desapareados en un complejo y con ello identificar su configuración en el estado basal. Un cálculo que tome en cuenta exclusivamente el espín puede fallar para los complejos d5 de bajo espín y para los 3d6 y 3d7 de alto espín. La distinción experimental entre complejos de alto y bajo espín se basa en la determinación de sus propiedades magnéticas. Los compuestos se clasificarán como diamagnéticos si son repelidos por un campo magnético y paramagnéticos si son atraídos por un campo magnético. Estos dos tipos de compuestos se pueden distinguir experimentalmente por magnetometría. La magnitud del paramagnetismo de un complejo se expresa comúnmente en términos del momento dipolar magnético que posee: cuanto mayor sea el momento dipolar magnético del complejo, mayor será el paramagnetismo de la muestra. Teoría de campo cristalino d) Mediciones magnéticas Nota: en un átomo o ión libre, tanto el momento orbital como el angular del espín dan lugar a un momento magnético que contribuye al paramagnetismo. Cuando el átomo o el ión es parte de un complejo, cualquier momento angular orbital normalmente se suprime – o se extingue – como resultado de las interacciones entre los electrones con su entorno no esférico. Sin embargo, el momento angular del espín se mantiene y da lugar al paramagnetismo exclusivo del espín, que es característico de muchos complejos de los metales d. El momento magnético exclusivo del espín, , de un complejo con número cuántico de espín total S es: 2 S S 1 1/ 2 B Donde , es un conjunto de constantes fundamentales conocidas con el nombre de magnetón de Bohr, e B 2me con el valor de 9,274 x 10-24 JT-1 Teoría de campo cristalino d) Mediciones magnéticas Una medida del momento magnético de un complejo del bloque d se puede interpretar generalmente en términos del número de electrones desapareados que contiene, así que la medición se puede utilizar para distinguir entre un complejo de alto y de bajo espín. En la tabla se muestran los valores calculados del momento magnético de espín para las configuraciones tx2geyg y se comparan con valores experimentales de varios complejos 3d. Teoría de campo cristalino d) Mediciones magnéticas Para la mayoría de los complejos 3d (y para algunos complejos 4d), los valores experimentales concuerdan bastante bien con las predicciones basadas en el espín solamente, por lo que es posible identificar correctamente el número de electrones desapareados y, por lo tanto, asignar la configuración de estado basal. Por ejemplo, el [Fe(OH2)6]3+ es paramagnético, con un momento magnético de 5,9 B. com se muestra en la tabla, este valor es consistente con el valor que se esperaría para el caso de que existan cinco electrones desapareados (y S=1/5), lo que implica una configuración de alto espín t32ge2g. Teoría de campo cristalino d) Ejemplos a) El momento magnético de cierto complejo octaédrico de Co(II) es 4,0 B. ¿Cuál es su configuración electrónica d? b) El momento magnético del complejo [Mn(NCS)6]4- es 6,06 B. ¿Cuál es su configuración electrónica? Teoría de campo cristalino e) Complejos tetraédricos Punto clave: en un complejo tetraédrico, los orbitales e se encuentran debajo que los orbitales t2;* sólo necesita considerar el caso de alto espín. El hecho de que los orbitales e queden debajo de los orbitales t2 se debe a que los primeros están orientados en direcciones que quedan entre los ligantes y sus cargas parcialmente negativas, mientras que los orbitales t2 apuntan más directamente hacia los ligantes. Teoría de campo cristalino e) Complejos tetraédricos Otra diferencia consiste en que el parámetro de desdoblamiento del campo de los ligantes, T, en un complejo tetraédrico es menor que O, como cabría esperar para complejos que tienen menos ligantes, ninguno de los cuales está orientado directamente hacia los orbitales d (de hecho, T4/9O). La energía de apareamiento es invariablemente más alta que T, por lo que sólo se encuentran complejos tetraédricos con alto espín. Las EECL se pueden calcular en la misma forma que se calculan para los complejos octaédricos. Las únicas diferencias son el orden de ocupación de los orbitales (e antes que t2) y la contribución de cada orbital a la energía total (3/5T para un orbital e y -2/5T para un orbital t2)*. * Debido a que en los complejos tetraédricos no hay centro de inversión, la designación de los orbitales no incluye el descriptor de paridad g o u. Teoría de campo cristalino e) Complejos tetraédricos En las siguientes tablas se muestran los valores calculados para la EECL y algunos valores experimentales de T para algunos complejos. Como se puede inferir de la tabla las configuraciones de los complejos dn son e1 e2 e2t21 e2t22 e2t23 e3t23 e4t23 e4t24 e4t25 e4t26 Teoría de campo cristalino f) Complejos planos cuadrados Punto clave: una configuración d8, junto con un campo de los ligantes alto, favorece la formación de complejos cuadrados planos Los cuatro ligantes, en un arreglo plano cuadrado, conllevan al desdoblamiento de los orbitales d que se muestra en la figura, con el orbital dx2- y2 en la posición más alta de todos. Este arreglo es energéticamente favorable cuando hay ocho electrones d y el campo cristalino es lo suficientemente fuerte para favorecer un arreglo de bajo espín d2yz d2zx d2z2 d2xy. Es por ello que se encuentran muchos complejos cuadrados planos para los complejos 4d8 y 5d8 de Rh(I), Ir(I), Pt(II), Pd(II), y Au(III), en los que existe un fuerte desdoblamiento del campo de los ligantes asociado con los metales de las series 4d y 5d. Parámetro de desdoblamiento de los orbitales para un complejo plano cuadrado Teoría de campo cristalino f) Complejos planos cuadrados En contraste, los complejos de los metales de la serie 3d, como el [NiX4]2-, con X como un halógeno, suelen ser tetraédricos debido a que el parámetro de desdoblamiento del campo de los ligantes es por lo general muy pequeño. Sólo cuando el ligante ocupa un nivel alto en la serie espectroquímica, la EECL es lo suficientemente grande como para formar de un complejo cuadrado, como acontece en el [Ni(CN)4]2-. La suma de los tres distintos desdoblamientos orbitales que se muestra en la figura se denota con PC. La teoría simple predice que PC = 1,3O para los complejos que tienen el mimo metal y ligantes con la misma distancia de enlace M-L. Parámetro de desdoblamiento de los orbitales para un complejo plano cuadrado Lecturas recomendadas • Patnaik P. Handbook of Inorganic Chemicals. MGH, 2003. Pag. 239. • Cotton F. Albert. Aplicaciones químicas de la teoría de grupos. Tercera edición. • Shriver and Atkins. Química inorgánica. Cuarta edición. Pags. 459 – 490. • Greenwood N.N y Earnshaw A. Chemistry of the elements. Pags. 11131143. • Huheey James E. Inorganic Chemistry: Principles of Structure and Reactivity. Cuarta edición. Pags. 387-488. • Miessler Gary L. Inorganic Chemistry. Tercera edición. Pags. 299-407.