Taller sobre La tabla periódica
Anuncio

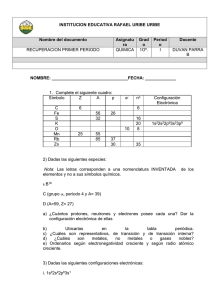
Taller sobre La tabla periódica 1. ¿Qué es la tabla periódica? 2. Diga qué principios rigen la configuración electrónica y qué indica c/u de ellos. 3. Indique ¿cómo determina el grupo y el período del sistema periódico al cual pertenece un elemento dado su número atómico? 4. Enumere los cuatro números cuánticos, diga qué representa c/u e indique los valores que pueden tomar. 5. Defina las distintas propiedades periódicas e indique ¿Cómo varían c/u de ellas en los grupos y en los períodos del sistema periódico? 6. El siguiente cuadro representa elementos representativos del Sistema Periódico: GRUPOS 1 2 13 14 15 16 17 18 A B C D E F G H I J K 6,1 De acuerdo a sus ubicaciones relativas, indique mediante la utilización de flechas a) Elemento de mayor radio: b) Elemento más electronegativo: c) Elemento con mayor potencial de ionización: d) Elemento con mayor número de electrones en su capa externa: e) Elemento con afinidad electrónica más positiva: f) Elemento con mayor Nº de electrones: g) Elemento de menor radio: h) Elemento menos reactivo: i) Elemento con menor potencial de ionización: 6,2. Indique si las siguientes aseveraciones son verdaderas o falsas: a) G es más electronegativo que F b) La afinidad electrónica de B es más positiva que la de A c) El potencial de ionización de I es menor que el de J d) El radio atómico de C es menor que el de E e) La electronegatividad de H es mayor que la de D f) El potencial de ionización de I es mayor que el de A g) El radio iónico de K es mayor que el radio iónico de G 7. ¿Qué otra clasificación del sistema periódico conoce? ¿Qué nombre tienen los elementos de los grupos IA, IIA y VIIA? 8. Indique los cuatro Nºs cuánticos del último electrón de los siguientes átomos: 12Mg, 15P, 30Zn, 24Cr, 17Cl. 9. Dando el siguiente esquema de la Tabla Periódica en forma genérica, en la que las letras no representan los símbolos de los elementos, seleccione la letra V si la proposición es verdadera y la F si es falsa: a) A y B son elementos no metálicos V-F b) N y E son elementos representativos V-F c) Z pertenece al quinto período V-F d) La electronegatividad de L es menor que la de N V-F e) C es un elemento del segundo grupo V-F f) Los elementos A, D, E, F y G pertenecen al primer período V-F g) Los átomos del elemento L tienen menor electroafinidad que los de A V-F h) El P.I. de F es menor que la de B V–F 10. Utilizando el mismo esquema de tabla periódica del ejercicio anterior lea cada una de las siguientes afirmaciones. Si son verdaderas encuadre la letra V. Si son falsas encuadre la F y coloque en el espacio en blanco la o las palabras que transformarían en verdadera la proposición falsa modificando solamente el o los términos subrayados: a) Los elementos, L, M y N son gases nobles b) La electronegatividad de Z es mayor que la de M c) Los electrones del nivel más externo de C son dos d) J es un metal e) C posee tres electrones en el último nivel ocupado g) W no conduce la corriente eléctrica en estado sólido h) La electronegatividad de L es mayor que la de K j) H e I son no metales V-F V-F V–F V-F V-F V-F V-F V-F 11. Un ion bivalente positivo posee 18 electrones y A = 41. a) Cuántos neutrones, protones y electrones tienen el átomo neutro y el ion?. b) Escriba la configuración electrónica del átomo neutro e indique en que grupo y período se encuentra en la tabla periódica. c) Dar la fórmula química del compuesto que forma con el oxígeno e indicar: i) si conducirá la corriente eléctrica, ii) en qué estado de agregación se encuentra a temperatura ambiente y 1 atm de presión. 12. Los elementos con símbolos genéricos V, W, X, Y y Z responden a las siguientes características: V: configuración electrónica 1s22s22p63s23p64s1 W: pertenece al 2° período grupo III A. X: Z= 54 Y: configuración electrónica 1s22s22p63s23p5 Z: es un alcalino térreo del cuarto período. a) Ordene V, W, Y y Z según el orden creciente de electronegatividad. b) ¿Cuáles conducirán la corriente eléctrica? 13. ¿Por qué los elementos de transición no presentan una variación tan marcada en los radios atómicos como los elementos representativos? ¿y en la energía de ionización? 14. Se tienen cuatro átomos arbitrarios D, E, F y G. Sus electronegatividades son: 3.8, 3.3, 2.8 y 1.3 respectivamente. Si los átomos de estos elementos forman moléculas DE, DG, EG y DF, ¿cómo acomodaría estas moléculas en orden creciente de su carácter de enlace covalente? 15. 16. Realiza la siguientes lectura C:\Users\manuel campillo-pc-\Documents\D P P CAMPILLO\DDPC 2014\G 10\Segunda fase\lectura-8c2ba-tabla-periodica1.doc 17. Repasa la organización de la tabla periódica dando clic en: http://platea.pntic.mec.es/pmarti1/educacion/3_eso_materiales/b_iii/conceptos/conceptos_bloque_3_3.htm#historia 2) Estudia en alguna de estas tablas periódicas interactivas: http://www.alonsoformula.com/inorganica/tabla_periodica.htm http://concurso.cnice.mec.es/cnice2005/93_iniciacion_interactiva_materia/curso/materiales/indice.htm http://www.ptable.com/ envía los pantallazos [email protected] 18. <ZXCVBNM,.-