TP 2 Normalizacion HCl y valoracion Mezclas alcalinas
Anuncio

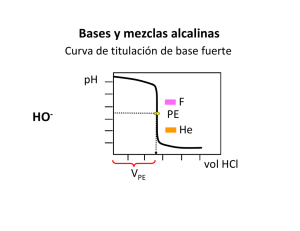
DEPARTAMENTO DE QUÍMICA ANALÍTICA CÁTEDRA DE QUÍMICA ANALÍTICA TRABAJO PRÁCTICO Nº 2 RESOLUCIÓN DE MEZCLAS ALCALINAS POR VOLUMETRÍA DE NEUTRALIZACIÓN 2015 1 INTRODUCCIÓN TEÓRICA: Las especies OH-, CO32- y HCO3- son las que confieren alcalinidad al agua mineral, a la cal, a la soda cáustica. Pueden hallarse como especie única o mezclas binarias; en este último caso sólo son compatibles OH-/CO32- y CO32-/HCO3-. La imposibilidad de que coexistan OH- y HCO3- viene dado por la siguiente reacción: HCO3- + OH- CO32- + H2O Para estas mezclas utilizaremos el método de Warder, que permite conocer los componentes presentes y la concentración de cada uno de ellos. Antes de desarrollar el método se hará un repaso de las curvas de titulación de cada una de las especies por separado y la disponibilidad de indicadores adecuados para evidenciar los puntos finales utilizando HCl normalizado como agente titulante. Consideraciones: Se realizan dos titulaciones sucesivas sobre la misma porción de muestra, usando dos indicadores con diferente rango de viraje: fenolftaleína (8 - 9,6) y heliantina (3,1 - 4,4). VF : volumen de HCl necesario para decolorar la fenolftaleína. VH: volumen de HCl necesario para viraje de color de la heliantina, considerando desde el viraje de la fenolftaleína. a) Si la muestra solamente contiene OH- : Se titula hasta viraje de la fenolftaleína; se habrá valorado el OH-, gastándose un volumen de HCl igual a VF. Además, VH = 0. Por lo tanto, si VF > 0 y VH = 0, la muestra contiene solo OH-. pH 9 Fenolftaleína 8 4 Heliantina 2 ml HCl b) Si la muestra solamente contiene CO32- : Se titula un equivalente hasta viraje de la fenolftaleína (CO32- + H+ HCO3-) y el otro equivalente hasta viraje de la heliantina (HCO3- + H+ H2CO3). Se cumple que : VF = VH . 2 pH 12 9 Fenolft aleína 4 Heliant ina 2 ml HCl c) Si la muestra solamente contiene HCO3- : Una solución de HCO3- no muy diluida tiene un pH = 8,3 , valor que prácticamente coincide con el límite inferior del ámbito de viraje de la fenolftaleína. Al titular una solución que contiene solamente HCO3-, la fenolftaleína permanece incolora. Puede decirse que: VF = 0 y VH > 0. pH 12 9 4 Heliantina 2 ml HCl d) Si la muestra contiene CO32- y OH-: Cuando se haya adicionado suficiente ácido para decolorar la fenolftaleína (VF) se habrán valorado la totalidad de los equivalentes de OH- y un equivalente de CO32- ; es decir: CO32- + H+ HCO3-. Mientras que VH corresponderá a la valoración del otro equivalente de CO32-: HCO3- + H+ H2CO3 . Cuando VF > VH la muestra contiene CO32- y OH- . e) Si la muestra contiene CO32- y HCO3- : Cuando se haya adicionado suficiente ácido para decolorar la fenolftaleína (VF) se habrá valorado un equivalente de CO32-, (CO32- + H+ HCO3-). El volumen de ácido gastado para virar la 3 heliantina (VH) corresponderá al otro equivalente de CO32- , ( HCO3- + H+ H2CO3 ) más el HCO3de la muestra: (HCO3- de la muestra + HCO3- proveniente del CO32- ). Cuando VH > VF la muestra contiene CO32- y HCO3- . _________________________________________________________________________________ TRABAJO PRÁCTICO Con anterioridad a la determinación de la composición de la mezcla alcalina incógnita se debe normalizar la solución de agente titulante. Se siguen los siguientes pasos: 1) Normalización de la solución de ácido clorhídrico aproximadamente 0,1 N. 2) Determinación de la composición de una mezcla alcalina por volumetría de neutralización. Materiales y Reactivos: En la mesada: Solución de HCl aproximadamente 0,1 N 1 bureta x 25,00 mL Solución de heliantina 1 % 2 erlenmeyers Solución de fenolftaleína 1 % 1 embudo Piseta con agua deionizada 1 pipeta aforada y calibrada x 5,00 mL 1 vaso de precipitado En el sector de balanzas: 1 probeta x 25 mL Carbonato de sodio patrón primario 1 piseta Espátula Solución alcalina incógnita Procedimiento:. 1) Normalizar la solución de HCl aproximadamente 0,1 N; realizar previamente los cálculos correspondientes para conocer la masa de patrón primario que deberá valorar. Desarrollo: pesar exactamente por diferencia la cantidad de carbonato de sodio estimada y colocarla en el erlenmeyer. Disolver en unos 50 mL de agua desmineralizada y agregar 2 (dos) gotas de heliantina; proceder a la titulación adicionando desde la bureta la solución de ácido hasta viraje del indicador. Calcular e informar la normalidad en base a dos titulaciones como mínimo. 2) Determinar la composición de una mezcla alcalina utilizando como titulante el ácido normalizado. Desarrollo: Colocar en el erlenmeyer 5,00 ml de la solución alcalina (exactamente medidos con pipeta aforada), agregar 2 (dos) gotas de fenolftaleína y valorar agregando desde la bureta la solución ácida 0,1 N hasta desaparición del color rosado. Leer el volumen gastado. 4 Adicionar 2 (dos) gotas de heliantina y seguir titulando hasta color anaranjado. Leer el volumen gastado. En base a los volúmenes observados deducir la composición de la mezcla alcalina. Calcular e informar los resultados en ppm de dos replicados como mínimo. _________________________________________________________________________________ PROBLEMAS Y CUESTIONARIO 1- Indique qué volumen de ácido clorhídrico (36,5 % P/P y =1,19 g/cm3) deberá tomar para preparar 200 mL de solución aproximadamente 0,1 N. PM HCl = 36,46 2- Realice los cálculos necesarios para conocer la masa de carbonato de sodio (patrón primario) que deberá pesar y posteriormente valorar con ácido clorhídrico aproximandamente 0,1 N utilizando como indicador heliantina; considere que dispone de una bureta de 25,00 mL. PM Na2CO3 = 106 3- La siguiente gráfica corresponde a la titulación de una misma porción de muestra de una mezcla equimolar de carbonatos y oxidrilos con HCl normalizado. Se consumieron 20,00 mL del ácido hasta viraje de la fenolftaleína y 10,00 mL más hasta el viraje de la heliantina. a) Escriba las especies químicas presentes en los puntos A, B y C. b) Indique qué equilibrios químicos están involucrados hasta el viraje de la fenolftaleína, y desde el viraje de la fenolftaleína hasta el viraje de la heliantina. pH A B C 10 20 30 Vol. HCl (mL) Concurrir al laboratorio con papel absorbente, guantes, gafas, guardapolvo, propipeta y rotulador indeleble. 5