Factor de Crecimiento Epidermal
Anuncio
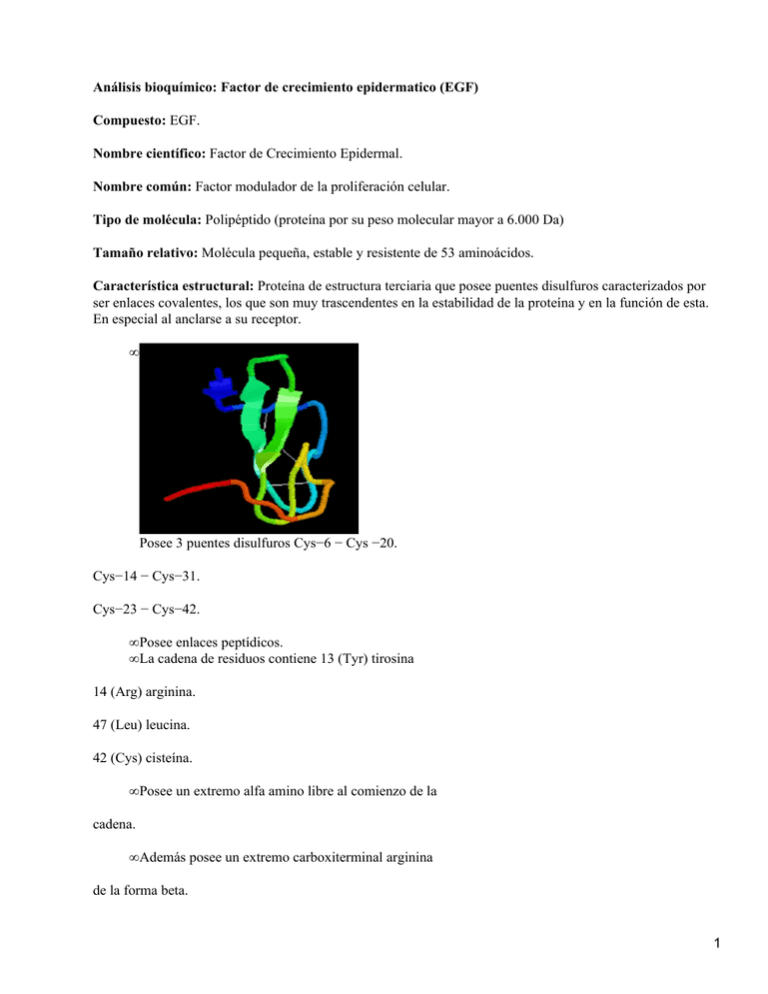
Análisis bioquímico: Factor de crecimiento epidermatico (EGF) Compuesto: EGF. Nombre científico: Factor de Crecimiento Epidermal. Nombre común: Factor modulador de la proliferación celular. Tipo de molécula: Polipéptido (proteína por su peso molecular mayor a 6.000 Da) Tamaño relativo: Molécula pequeña, estable y resistente de 53 aminoácidos. Característica estructural: Proteína de estructura terciaria que posee puentes disulfuros caracterizados por ser enlaces covalentes, los que son muy trascendentes en la estabilidad de la proteína y en la función de esta. En especial al anclarse a su receptor. • Posee 3 puentes disulfuros Cys−6 − Cys −20. Cys−14 − Cys−31. Cys−23 − Cys−42. • Posee enlaces peptídicos. • La cadena de residuos contiene 13 (Tyr) tirosina 14 (Arg) arginina. 47 (Leu) leucina. 42 (Cys) cisteína. • Posee un extremo alfa amino libre al comienzo de la cadena. • Además posee un extremo carboxiterminal arginina de la forma beta. 1 Grupos funcionales: Para que EGF se una a la célula lo hace a través de su receptor de esta manera dilucidamos su grupo funcional de pendiendo de los dominios donde este se ancla. Este receptor(r−EGF) posee 3 segmentos o dominios: • Dominio extracelular: compuesto por 621 aminoácidos. • Dominio transmembranal: compuesto por 23 aminoácidos hidrofobicos. • Dominio extracelular: contiene 542 aminoácidos y posee una porcion con actividad enzimatica capaz de introducir grupos fosfatos (fosforilar) en otras proteínas y 4 sitios en que pueden también ser fosforilada; una trionina (654 aa) y tres tirosinas (1068,1148,1173 aa). Este r− EGF ubicado sobre el cromosoma 7 tiene la capacidad de fosforilar por su actividad proteica tyrosina−kynasa adquiriendo afinidad y fijando al receptor (EGF) a un punto isoelectrico de 5 a 8 (ph) formando un enorme complejo (Src). Los lugares de dominio de anclaje son llamados SH−2 . r−EGF también se conoce como confusamente Erb B1, Erb B2, oncogén Erb B y HER 1. En la membrana se ubican 2 moléculas de esta proteína fijadora con un peso molecular de cada uno aprox. 74.000 Da. Esta proteína es codificada por un genHER_2/nau (C−erb B−2). Presencia: En todos los seres vivos especialmente en dermis, epidermis y anexos cutáneos ( queratinositos basales, conductos sudoríparos ecrinos, células de la vaina externa y de la raiz del folícul; sebocitos basales.) Funciones: El EGF es una proteína mitogenica ubicada en el cromosoma 4, con un peso molecular de 6.045 Da, como nombre alternativo se denomina urogastrona (URG). Este debe unirse a su receptor para incorporarse a la célula, luego sufre una fosforilación para activar a un gen correspondiente y dar declive a la síntesis de ADN produciendo una cascada de reacción que lleva a la proliferación celular. • Puede llegar a la circulación y ejercer su acción de tres forma: sobre las propias células que la fabricaron (autocrina), sobre las células vecinas ( parocrina), y sobre células lejanas si son absorbidas dentro de la circulación sanguínea (endocrina). • Promueve el crecimiento de las células y la diferenciación esencial en la embriogénesis e importante en la cicatrización. • También llamado beta−urogastrona con actividad inhibitoria de secreción gástrica. • Restaura la vitalidad cutánea, aumenta el grosor, recupera la consistencia elástica, aumenta la afluencia vascular mejorando las secreciones e incrementando la textura de la piel. • Posee carácter regulador y posee actividad hidrolizante y da origen a mas de un polipéptido activo. • Efecto neurorrestaurador de nervios periféricos lesionados. • Efecto hepatoprotector ante la intoxicación con una hepatoxina (CCA4) • Efecto nefroprotector ante el episodio de isquemia. (reperfusión). • Previene lesiones intestinales, vasculares y renales; y estimula la sobrevida de animales quemados severamente. Enfermedad relacionada: envejecimiento innato y cronológico; y de la radiación solar, producto de su déficit en las capas de la dermis y además aplicación clínica en acelerar la separación de las heridas corneales después de cirugías, quemaduras y úlceras. Inhibidor: Se constituye en potencial terapéutico contra el cáncer,creandose anticuerpos monoclonales que inhiben en el dominio externo del r−EGF produciendo apoptosis. Esta inhibición impide la fosforilación de tyosina−kyasa y ademas se puede lograr la acción directa ante el complejo activado. Dentro de estos anticuerpo monoclonales tenemos: 2 • Erbitux (cituximab), anti HER1. − Herceptin (trasuzumab) anti HER2. − Mabthera (rituximab) anti CD20. − Avastin (bevacimab) anti TNF alfa. − Synagis (polynzumab) anti virus sincitial. − Zenapax (deolizumab) anti CD25. Además existen moléculas que inhiben el bloqueo directamente de la fosforilación de la tyrosina−kynasa: • HER1+K Y nh. Dual HER1−2 TK Ynh. PANHERTKinh. • TARCEVA PKI CI 1033 • IRESSA GW 2016PP 158780. Todas estas sustancias son toleradas por vía oral y aumentan la calidad de vida. Sitios de expresión: Riñón como fuente principal de difundir EGF, mamas, tracto gastrointestinal, vasos sanguíneos, trompas de Falopio, colon, útero, intestino, ovario, leche, páncreas, próstata, piel y orina. Referencias: − Blanco A, Química Biológica, 7ª ed,2001, El Ateneo. − Foye W, Principles of Medicinal Chimistry, 6ª ed, 1995, Williams & Wilkins. − Lheninger A, Principio de Bioquímica, 1995, Barcelona, Omega. − Macmurry J, Química Organica, 2001, International Thomson editores. − http//www.med−estetica.com/Científica/Revista/n3/factorcrecmesa.html. − http//www.ncbi.nlm.gov/intrez/dispomim.cgi?id=131530.html. − http//www.medterns.com − http//www.doyma.es/ − http//www.galemored.com _http//www.siveduc.cl/ FACTOR DE CRECIMIENTO EPIDÉRMICO EFG Blanco A., Química Biológica, 7ª Ed, 2001, El Ateneo. Protooncogen cambiado cuya principal manifestación es su proliferación desordenada incontrolada e invasiva. (Blanco A., Química Biológica) Dilucidado por Scott en el año 1999 en estudios bioquímicos_ farmacológicos. (http//www.galemored.com/) Muerte celular programada en células.( Blanco A) Universidad Austral de Chile Instituto de Bioquímica 3 Facultad de Ciencias 4











