10 R EACCIONES DE TRANSFERENCIA DE
Anuncio

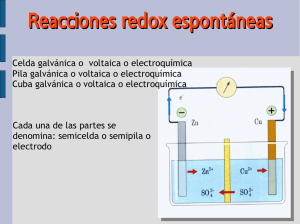
10 OBJETIVOS DIDÁCTICOS REACCIONES DE TRANSFERENCIA DE ELECTRONES – Reconocer reacciones de oxidación-reducción por la transferencia de electrones entre dos especies químicas. – Conocer las reglas que se utilizan para asignar el número o estado de oxidación de un elemento en una especie química. – Identificar el agente oxidante y el agente reductor en una reacción redox analizando los cambios en el número de oxidación de las especies químicas que intervienen. – Saber aplicar el método del ión-electrón para ajustar ecuaciones redox en medio ácido, neutro y básico. – Reconocer el funcionamiento de una pila voltaica capaz de transformar la energía química de una reacción redox en energía eléctrica. – Saber representar e interpretar el diagrama de una pila siguiendo las reglas de notación adecuadas. – Conocer el concepto de potencial de reducción de un electrodo y saber aplicar la ecuación de Nernst. – Determinación de la espontaneidad de la reacción redox a partir del valor de cambio de energía libre. – Conocer el proceso de la electrolisis, la reacción redox electrolítica, su estequiometría y las leyes de Faraday. – Definición histórica de oxidación-reducción. CONTENIDOS – Concepto actual de oxidación-reducción. – Aplicación de las reglas que permiten asignar el número de oxidación de un elemento. 10 – Diferenciación entre agente oxidante y agente reductor. – Identificación del oxidante y del reductor en una reacción. – Mecanismo de ajuste de ecuaciones redox en medio ácido o neutro y en medio básico utilizando el método del ión-electrón. – Valoración redox y concepto de autoindicadores. – Descripción de una pila voltaica. – Definición de fuerza electromotriz de una pila. – Representación e interpretación del diagrama de una pila. – Reconocimiento de las condiciones en las que se define el electrodo estándar de hidrógeno. – Determinación del potencial de reducción de un electrodo. – Cálculo de la fuerza electromotriz de cualquier pila a partir de los potenciales de reducción estándar. – Deducción matemática de la ecuación de Nernst. – Determinación del potencial de electrodo en condiciones no estándar utilizando la ecuación de Nernst. © VICENS VIVES – Espontaneidad de la reacción redox. – Análisis de las características termodinámicas de la corrosión del hierro. – Enumeración de medidas preventivas para evitar la corrosión. – Concepto de electrolisis y leyes de Faraday. – Cálculo de la estequiometría de la electrolisis. 10-2 10 CRITERIOS DE EVALUACIÓN REACCIONES DE TRANSFERENCIA DE ELECTRONES – Asegurarse de que el alumnado reconoce una reacción de oxidación-reducción por la transferencia de electrones entre dos especies químicas. – Observar que determinan el número de oxidación de un elemento en una especie química aplicando las reglas establecidas. – Cerciorarse de que los estudiantes saben identificar el agente oxidante y el agente reductor en una reacción redox. – Detectar si el alumnado sabe ajustar ecuaciones redox aplicando el método del iónelectrón en medios ácidos, neutros y básicos. – Confirmar que conocen el funcionamiento de una pila voltaica y saben representar e interpretar un diagrama de pila. – Asegurarse de que relacionan el potencial de reducción de un electrodo con la fuerza electromotriz de una pila compuesta por dicho electrodo y un electrodo de hidrógeno en condiciones estándar. – Confirmar que los estudiantes saben calcular el potencial redox de una pila utilizando la ecuación de Nernst. – Comprobar si el alumnado sabe predecir la espontaneidad de una reacción redox considerando los valores del potencial redox y de variación de energía libre. – Comprobar que describen el proceso de corrosión del hierro a causa del oxígeno y del agua en términos de proceso redox. – Cerciorarse de que los estudiantes saben enumerar algunas medidas preventivas de la corrosión. – Observar si el alumnado describe el proceso de electrolisis en una cuba electrolítica que contiene un electrolito. 10 – Observar que conocen las leyes de Faraday y las aplican a la estequiometría de la electrolisis. – Competencia matemática. Se trabaja en tanto que el alumnado debe utilizar las ecuaciones que describen las reacciones de reducción-oxidación y su estequiometría. – Competencia en tratamiento de la información. Se valora la capacidad del alumnado para utilizar las reglas de representación de dispositivos y procesos relacionados con las reacciones redox. – Competencia en autonomía e iniciativa personal. Se desarrolla en tanto que el alumnado debe identificar los procesos de reducción y de oxidación en una situación problemática dada. – Competencia para aprender a aprender. Se trabaja en tanto que los alumnos deben comprobar las soluciones de las actividades resueltas y analizar las causas de los posibles errores cometidos. © VICENS VIVES COMPETENCIAS 10-3