UNIVERSIDAD CENTRAL DE VENEZUELA FACULTAD DE AGRONOMIA DEPARTAMENTO DE QUIMICA Y TECNOLOGIA
Anuncio
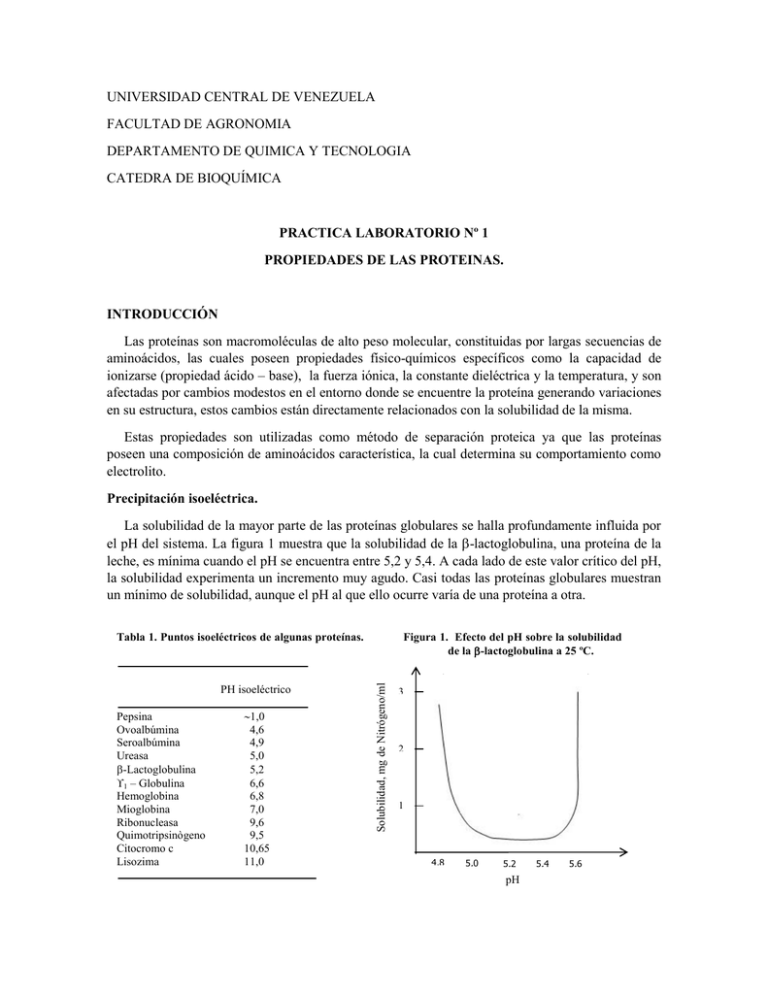
UNIVERSIDAD CENTRAL DE VENEZUELA FACULTAD DE AGRONOMIA DEPARTAMENTO DE QUIMICA Y TECNOLOGIA CATEDRA DE BIOQUÍMICA PRACTICA LABORATORIO Nº 1 PROPIEDADES DE LAS PROTEINAS. INTRODUCCIÓN Las proteínas son macromoléculas de alto peso molecular, constituidas por largas secuencias de aminoácidos, las cuales poseen propiedades físico-químicos específicos como la capacidad de ionizarse (propiedad ácido – base), la fuerza iónica, la constante dieléctrica y la temperatura, y son afectadas por cambios modestos en el entorno donde se encuentre la proteína generando variaciones en su estructura, estos cambios están directamente relacionados con la solubilidad de la misma. Estas propiedades son utilizadas como método de separación proteica ya que las proteínas poseen una composición de aminoácidos característica, la cual determina su comportamiento como electrolito. Precipitación isoeléctrica. La solubilidad de la mayor parte de las proteínas globulares se halla profundamente influida por el pH del sistema. La figura 1 muestra que la solubilidad de la -lactoglobulina, una proteína de la leche, es mínima cuando el pH se encuentra entre 5,2 y 5,4. A cada lado de este valor crítico del pH, la solubilidad experimenta un incremento muy agudo. Casi todas las proteínas globulares muestran un mínimo de solubilidad, aunque el pH al que ello ocurre varía de una proteína a otra. PH isoeléctrico Pepsina Ovoalbúmina Seroalbúmina Ureasa -Lactoglobulina 1 – Globulina Hemoglobina Mioglobina Ribonucleasa Quimotripsinògeno Citocromo c Lisozima 1,0 4,6 4,9 5,0 5,2 6,6 6,8 7,0 9,6 9,5 10,65 11,0 Figura 1. Efecto del pH sobre la solubilidad de la -lactoglobulina a 25 ºC. Solubilidad, mg de Nitrógeno/ml Tabla 1. Puntos isoeléctricos de algunas proteínas. 3 2 1 4,8 5,0 5,2 pH 5,4 5,6 El pH al que una proteína muestra un mínimo de solubilidad es su pH isoeléctrico, definido como aquel valor de pH al que la molécula no posee carga eléctrica y es incapaz de desplazarse en un campo eléctrico (tabla 1). En estas condiciones no existe repulsión electrostática entre moléculas de proteína vecinas y tienden a coalescer y precipitar. Sin embargo, cuando los valores de pH están por encima o por debajo del punto isoeléctrico, todas las moléculas de proteína poseen una carga eléctrica neta del mismo signo. Por dicha razón, se repelen mutuamente, impidiendo la coalescencia de las moléculas sencillas para formar agregados insolubles. Algunas proteínas son virtualmente insolubles en sus pH isoeléctricos. Puesto que las diferentes proteínas poseen valores de pH isoeléctrico también diferentes, debido a que difieren en el contenido de aminoácidos con grupos R ionizables, con frecuencia pueden separarse unas de otras, mediante precipitación isoeléctrica. La proteína isoeléctrica precipitada permanece en su conformación nativa, y puede redisolverse en un medio de pH apropiado y concentración salina adecuada. Para una proteína determinada, el pH isoeléctrico variará según la composición iónica del medio, puesto que las proteínas pueden unirse a ciertos aniones o cationes. Cuando una disolución de proteína se dializa a fondo frente a agua destilada para eliminar todos los iones pequeños distintos de la H+ y OH-, el pH de la disolución resultante se conoce como pH isoiónico. El pH isoiónico es constante para cualquier proteína determinada. Solubilización y precipitación por salado de las proteínas. La capacidad de las sales neutras para influir en la solubilidad de las proteínas está en función de su fuerza iònica (fig. 1), que constituye una medida tanto de la concentración como de número de las cargas eléctricas existentes en los cationes y los aniones aportados por la sal. Fig. 2. Efecto de una sal neutra (K2SO4) sobre la solubilidad de la Carbonil-hemoglobina Log de la Solubilidad 0,6 0,4 0,2 Fig. 1. 0,0 Efecto de una sal neutra (K2SO4) sobre l solubilidad de la carbonil-hemoglobina a s pH isoeléctico. - 0,2 1,0 2,0 Fuerza iónoca Las sales neutras ejercen efectos pronunciados sobre la solubilidad de las proteínas globulares. A baja concentración, las sales incrementan la solubilidad de muchas proteínas, fenómeno que recibe el nombre de solubilización por salado. Las sales de los iones divalentes tales como el MgCl2 y el (NH4)2SO4, son mucho más eficaces en la solubilización de las proteínas que las sales de iones monovalentes tales como el NaCl, el NH4Cl, y el KCl. El efecto de solubilidad por salado está causado por cambios de la tendencia a la ionización de los grupos R disociables de la proteína. Por otra parte, a medida que la fuerza iónica aumenta, la solubilidad de una proteína comienza a disminuir. A una fuerza iónica lo suficientemente elevada, una proteína puede ser casi completamente precipitada de su disolución, efecto llamado insolubilización por salado. La base físico-química de la insolubilización por salado es bastante compleja; uno de los factores que concurren en ella es que la concentración elevada de la sal puede eliminar el agua de hidratación de las moléculas de proteína, reduciendo su solubilidad; pero también están implicados otros factores. La solubilización y la insolubilización por salado, son procedimientos importantes para la separación de mezclas de proteínas, ya que las diferentes proteínas varían en su respuesta frente a la concentración de sales neutras. Las proteínas precipitadas por salado retienen su conformación nativa y pueden disolverse de nuevo, normalmente sin experimentar desnaturalización. El sulfato amonio es el preferido para precipitar las proteínas por salado, debido a su gran solubilidad en agua, lo que permite alcanzar fuerzas iónicas muy elevadas. Fraccionamiento con disolventes. La adición de disolventes orgánicos neutros miscibles con el agua, particularmente etanol o acetona, disminuye la solubilidad de la mayor parte de las proteínas globulares en el agua, de tal manera que precipitan en su disolución. El estudio cuantitativo de este efecto muestra que la solubilidad de una proteína a un pH y fuerza iónica determinados está en función de la constante dieléctrica del medio. Puesto que el etanol posee una constante dieléctrica menor que la del agua (Fig. 3), su adición a una disolución acuosa de proteína incrementa la fuerza de atracción entre las cargas opuestas, disminuyendo de este modo el grado de ionización de los grupos R de la proteína. Como resultado, las moléculas de proteína tienden a agregarse y precipitan. Fig. 3. Efecto de la constante dieléctrica del agua sobre la solubilidad de las proteínas 0,6 Agua % de Solubilidad 0,8 0,4 0,2 20 40 60 80 Constante Dieléctrica (C.D.) Fig. 3. Efecto de la constante dieléctrica del agua en la solubilidad de las proteínas Las mezclas de proteínas pueden separarse basándose en las diferencias cuantitativas de su solubilidad en mezclas frías de etanol- agua. Una desventaja de este método es que al poder estos disolventes desnaturalizar a las proteínas a temperaturas superiores, la temperatura a que se trabaja debe mantenerse muy baja. Efecto de la temperatura sobre la solubilidad de las proteínas. Dentro de una fluctuación limitada entre los 0 y los 40º C aproximadamente, la mayor parte de la solubilidad de las proteínas globulares aumenta al aumentar la temperatura, aunque existen algunas excepciones, como ocurre con los electrólitos sencillos. Por encima de los 40 y los 50ºC, la mayor parte de las proteínas aumentan en inestabilidad y comienzan a desnaturalizarse, como puede observarse en la figura 4. Los procedimientos de fraccionamiento de proteínas se realizan por norma general a 0ºC o a temperaturas de refrigerador, ya que la mayor parte de las proteínas son estables a bajas temperaturas; sin embargo, existen excepciones. Algunas proteínas son más estables y su solubilidad es máxima a temperatura ambiente o a la temperatura de su entorno celular normal Figura 4. Efecto de la Temperatura en la solubilidad de las proteínas % de Solubilidad 0,8 0,6 Fig. 4. Efecto de la temperatura en la solubilidad de las proteínas 0,4 0,2 20 OBJETIVOS 40 60 80 Temperatura (º C) Determinar el efecto del pH, temperatura, constante dieléctrica y fuerza iónica sobre la solubilidad de las proteínas. Demostrar las propiedades ácido-base de las proteínas Determinar la zona de pH isoeléctrico de una proteína mediante ele efecto combinado de pH y temperatura. MATERIALES Y REACTIVOS Tubos de ensayo Ácido Sulfúrico (H2SO4) 1Mc Gradilla Hidróxido de Sodio (NaOH) al 1 % Sulfato de Amonio (NH4)2SO4 (10%) Sulfato de Amonio (NH4)2SO4 (50%) Etanol Solución de Albumina Buretas Cilindro graduado de 10ml Agua destilada EXPERIMENTO Nº 1. DETERMINACION DEL pHI POR TERMOCOAGULACION Debe colocarse simultáneamente los 3 tubos a 70 ºC por 40 seg (medio neutro, medio ácido, medio alcalino). a) Medio neutro En un tubo de ensayo agregar 3 ml de albúmina y colocarlo a 70 ºC por 40 segundos Observe y tome nota. b) Medio Ácido En un tubo de ensayo agregar 3 ml de albúmina y 3 gotas de Ac. Sulfúrico (1Mc) colocar a 70 ºC por 40 seg., Observe y tome nota. c) Medio Alcalino En un tubo de ensayo agregar 3 ml de albúmina y 5 gotas de NaOH al 1%, colocar a 70 ºC por 40 seg., Observe y tome nota. Preparar un patrón con 3ml de albúmina para hacer la comparación de los resultados obtenidos. EXPERIMENTO Nº 2. FACTORES QUE AFECTAN LA SOLUBILIDAD DE LAS PROTEINAS. Procedimiento a) Solubilidad e Insolubilidad por salado (fuerza iónica) En dos (2) tubos de ensayo agregar 3 ml de albúmina a cada uno. Luego adicionar 2 ml de Sulfato de amonio al 10% a uno de los tubos y al otro 2ml de sulfato de amonio al 50%. Observe y tome nota. b) Efecto del disolvente sobre la solubilidad. b.1.- Con solvente orgánico (etanol) En un tubo de ensayo agregar 3 ml de albúmina y 2 ml de etanol. Observe y tome nota. b.2.- Con agua En un tubo de ensayo agregar 3 ml de albúmina y 2 ml de agua destilada. Observe y tome nota c) Efecto de la temperatura En un tubo de ensayo agregar 3 ml de albúmina y colocar en calentamiento a 70ºC por 1 minuto observe y tome nota Preparar un patrón con 3 ml albúmina para hacer la comparación de los resultados obtenidos. UNIVERSIDAD CENTRAL DE VENEZUELA Fecha FACULTAD DE AGRONOMIA Sección DEPARTAMENTO DE QUIMICA Y TECNOLOGIA CATEDRA DE BIOQUÍMICA FORMATO PARA REGISTRO DE RESULTADOS DEL LABORATORIO Nº 1 NOMBRE CÉDULA PROPIEDADES DE LAS PROTEÍNAS EXPERIMENTO Nº 1 Determinación de la zona de pHI por Termo coagulación Tratamiento Ácido Neutro Alcalino En qué rango de pH se encuentra el pHI de la albúmina Resultado EXPERIMENTO Nº 2. Otros factores que afectan la solubilidad de las proteínas Tratamiento Sulfato de amonio 10% Sulfato de amonio 50% Etanol Agua Temperatura Resultado

