QU20604 Cinetica Quimica
Anuncio

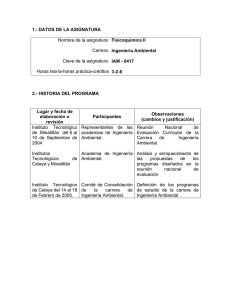
UNIVERSIDAD DE GUANAJUATO l NOMBRE DE LA UNIDAD Facultad de Química ACADÉMICA: NOMBRE DEL PROGRAMA Licenciaturas en Químico ACADÉMICO: NOMBRE DE LA UNIDAD DE APRENDIZAJE: Cinética Química SEMESTRE EN QUE SE IMPARTE CURSADA Y APROBADA: CURSADA: Cuarto PRERREQUISITOS: Ninguno FISICOQUÍMICA II CLAVE: QU20604 HORAS/SEMANA/SEME S-TRE TEORÍA: PRÁCTICA: CRÉDITOS: CARACTERIZACIÓN DE LA UNIDAD DE APRENDIZAJE X FORMATIX METODOLÓX POR EL TIPO DE DISCIPLICONOCIMIENTO: NAR VA GICA POR LA DIMENSIÓN DEL ÁREA ÁREA ÁREA PROFE- X CONOCIMIENTO: BÁSICA GENERAL SIONAL X TALLER X SEMINAPOR LA MODALIDAD DE CURSO LABORATOABORDAR EL RIO RIO CONOCIMIENTO: X OPTATIVA POR EL CARÁCTER DE LA OBLIGATO- X RECURSASELECTIUNIDAD DE APRENDIZAJE: RIA BLE VA X ES PARTE DE UN TRONCO SÍ NO COMÚN: COMPETENCIA (S) GENERAL(ES) DE LA UNIDAD DE APRENDIZAJE: Aplicar y/o desarrollar modelos que representen la realidad y generen nuevos conocimientos. Hablidad de manejo de reacciones y métodos de seguimiento de las mismas. CONTRIBUCIÓN DE LA UNIDAD DE APRENDIZAJE AL LOGRO DEL PERFIL DE EGRESO 3 3 9 ACREDI -TABLE El estudiante contará con conocimientos básicos de la Cinética Química desde los enfoques fenomenológico y molecular que contribuirán a que sea capaz de : Aplicar y/o desarrollar modelos que representen la realidad y generen nuevos conocimientos. Diseñar, conducir e interpretar experimentos y modelos que permitan obtener información que se requiere en su el campo profesional. Identificar problemas y proponer soluciones. Manejar paquetes básicos y especializados de cómputo. UNIDADES Y OBJETOS DE ESTUDIO CINÉTICA QUÍMICA Objetivo: Comprender los factores que afectan a la velocidad de una reacción y aplicar este conocimiento para obtener la Ley de Velocidad del sistema en estudio y proponer y validar un mecanismo probable por el cual se lleva a cabo la reacción en estudio. 1 Introducción 1.1 Estabilidad 1.2 Estabilidad Termodinámica 1.3 Estabilidad Cinética 1.4 Definición y campo de estudio de la Cinética Química 1.5 Ubicación de la Cinética Química dentro de la Fisicoquímica 1.6 Definición de Reacción Química y sistema reaccionante 1.7 Relaciones estequiométricas entre los componentes del sistema reaccionante 1.8 Grado de conversión y avance de reacción 1.9. Clasificación de la cinética según las fases involucradas en la reacción. 1.10 Clasificación de la cinética por el tipo de procesos (continuo o discontinuo). 1.11. Clasificación de las reacciones a estudiar desde el punto de vista de la Cinética Química 2. Conceptos Básicos 2.1 Definición de Velocidad de Reacción. 2.2 Interpretación geométrica de la velocidad media y de la velocidad instantánea. 2.3 Interpretación de gráficos concentración vs tiempo en reacciones químicas 2.4 Derivación numérica, correlación y regresión polinomial, Manejo de hoja de 2.5 Cálculo de las velocidades de Reacción 2.6 Ley de Velocidad o Ecuación Cinética. 2.7 Orden de reacción y constante de velocidad 2.8 Mecanismo de Reacción 2.9 Reacción Global 2.10 Reacción Elemental 2.11 Reacciones complejas 2.12 Molecularidad 2.13 Factores que afectan a la velocidad de reacción 2.14 Métodos y técnicas Experimentales. cálculo Excel. 3 Obtención de órdenes de reacción y constantes de velocidad. 3.1 El Método Diferencial 3.2 Reacciones reversibles en las que interviene un único reactivo 3.3 Reacciones reversibles en las que intervienen más de un reactivo 3.4 Reacciones reversibles en las que intervienen más de un reactivo, método del exceso y el concepto de pseudo orden. 3.5 3.6 Método de las velocidades iniciales. 3.7 El método integral 3.8 Reacción Irreversible de orden cero 3.9 Reacción Irreversible de uno 3.10 Reacción Irreversible de tipo I 3.11 Reacción Irreversible de dos tipo 2 3.13 Reacción Irreversible de orden 3 tipo 1 3.14 Aplicación del Método integral a reacciones de pseudo orden. 315 Método de los tiempos de vida fraccional. 3.16 Reacciones reversibles 3.17 Reacciones paralelas 3.18 Reacciones consecutivas 3.19 Uso de propiedades físicas con los datos cinéticos 3.20 Método integral cuando se desconoce el “punto final” de la reacción. 4 Mecanismos de reacción. 4.1. El estado de transición 4.2 Interpretación mecanística de las leyes de velocidad 4.3 Aplicación de la aproximación del estado estacionario para la obtención de la ley de velocidad a partir del mecanismo propuesto. 4.4 La etapa determinante de la velocidad de Reacción 4.5 La aproximación del pre equilibrio 4.6 De ley de Velocidad a mecanismo. 5. Efecto de la temperatura sobre la velocidad de reacción. 5.1. Ecuación de Arrhenius. Energía de Activación. 6 Teoría Cinética de los Gases 6.1 Postulados y Presión 6.2 Definiciones y distribuciones de velocidades de las partículas de un gas 6.3 Colisiones de las partículas de un gas 6.4 Efusión y difusión 7 Teorías de la Velocidad de Reacción. 7.1 Teoría Cinética de las Colisiones: mono moleculares, bimoleculares, trimoleculares 7.2 Teoría del Complejo Activado. 8. Catálisis homogénea. 8.1 Catálisis ácido base 8.2 Catálisis Enzimática SUGERENCIAS METODOLÓGICAS Se propone abordar el curso como un curso que sin ser propiamente un taller, considera de alta importancia la interacción entre la teoría y el laboratorio, En la sección de teoría las actividades de aprendizaje propuestas incluyen: Lecturas específicas, Exposición oral, Resolución de problemas, Trabajo en equipo, y los productos del aprendizaje serán: Tareas, Resolución de problemas del tema en clase, Examen parcial, exposición y discusión de temas asignados por el maestro en conjunto con los estudiantes. Incorporar en estos temas ejes transversales como son la relación del hombre con el medio ambiente y el desarrollo sustentable, comprendiendo el impacto de la actividad humana en el entorno. Desempeño en el laboratorio. Deberá el alumno de cumplir con las reglas de seguridad adecuadas, cumplir en forma íntegra la metodología a desarrollar, éste se evaluará por sesión de laboratorio. Elaboración de bitácora. Será individual, en ella se anotará el trabajo pre-laboratorio y los eventos que se consideren pertinentes acerca del trabajo experimental. La bitácora se revisará cada sesión. SUGERENCIAS PARA LA EVALUACIÓN DE LOS APRENDIZAJES Evaluación: Se considera la evaluación en sus 3 momentos: diagnóstica, formativa y sumaria. En la evaluación diagnóstica, se realiza una actividad diagnóstica al inicio del curso para valorar los conocimientos previos de los estudiantes, la evaluación formativa, se realiza de forma permanente llevando un registro del proceso de aprendizaje de los alumnos, a partir de valorar trabajos, tareas, participación, etc. La evaluación sumaria, en el cuál se establecen los exámenes parciales y trabajos finales del curso, y tiene como finalidad valorar el proceso de aprendizaje y asignar la calificación final de la materia. Calificación: a) Calificación de Teoría Se aplicarán tres exámenes parciales escritos que cubrirán cada uno la parte correspondiente del programa. El promedio de estas calificaciones parciales dará la calificación de teoría. Las tareas se revisan y solo tienen el propósito de prepara mejor al estudiante. b) Calificación del laboratorio Calificación FINAL: - La calificación del laboratorio representa el 30% de la calificación final de la materia. La teoría es el 70% restante. • • • BIBLIOGRAFÍA BÁSICA Castellan, G.W., Fisicoquímica, tercera edición Addison-Wesley Iberoamericana, 1987. Atkins, P., de Paula Julio, Physical Chemistry, 7th edition, W.H. Freeman and Company, New York, USA, 2002. Levine, Ira N., Fisicoquímica, Segunda edición, McGraw Hill Latinoamericana, 1991. BIBLIOGRAFÍA COMPLEMENTARIA • • Berry, R.S., Rice, S.A., Ross, J., Physical Chemistry, John Wiley & Sons, Inc., U.S.A., 1980. Raff, L.M., Principles of Physical Chemistry, Prentice Hall, 2001. ELABORADA POR: Q.F.B. JOSÈ ARNULFO PRADO TORRES, DR. MANUEL VILLANUEVA GARCÍA. FECHA DE ELABORACIÓN: FEBRERO 2008 FECHA DE REVISIÓN