teoría de iones - Colegio Virgen del Carmen de Cuyo
Anuncio

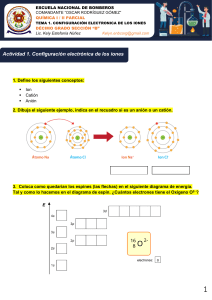
Instituto Virgen del Carmen de Cuyo Curso: Nombre y Apellido: Prof: Daniela Morán Fecha: CS. NATURALES: Química INDICADOR DE LOGRO: Describir la estructura atómica y molecular. ----------------------------------------------------------------------------------------------------------------------------------INTRODUCCIÓN A IONES Recuerda!!!! Así representamos los átomos…. En el núcleo los p+, que es igual al número atómico (número que aparece en grande en la tabla). Los neutrones se obtienen restando al número másico el atómico (en la tabla figura como masa atómica) En las órbitas van los electrones, que en la tabla aparecen como la distribución de electrones en niveles. El número del periodo indica la cantidad de órbitas Protón Neutrón Electrón Todos los átomos tienden a cumplir Una regla: La regla del octeto: y como su nombre lo indica, tienden a completar su último nivel con 8 electrones. Esto lo logran ganando, perdiendo o compartiendo electrones con otros átomos, para parecerse en su estructura electrónica a los gases nobles, que son estables (es decir, que ya tienen los 8 e- en su última órbita, a excepción del Helio que tiene 2 pero también es estable). Una vez que los átomos ganan o pierden electrones quedan con carga eléctrica, y se los llama IONES. Los IONES pueden ser de dos tipos: CATIONES: Son los iones que tienen carga positiva, porque han perdido electrones (que tienen cargas negativas). Los cationes son formados por los metales que tienen pocos electrones en su última órbita. Los metales pierden todos los electrones de su última órbita Para nombrarlos se antepone la palabra catión y se sigue con el nombre del metal correspondiente (por ejemplo: catión sodio). ANIONES: Son los iones que tienen carga negativa, porque han ganado electrones (que tienen cargas negativas). Los aniones son formados por los no metales que tienen muchos electrones en su última órbita. Los no metales ganan tantos electrones como los que le faltan para llegar a 8 en su última órbita. Para nombrarlos se antepone la palabra anión y se sigue con el nombre del no metal correspondiente, quitando las últimas letras y reemplazándolas por la terminación “uro” (por ejemplo: anión cloruro A continuación te doy un ejemplo de cada ión…. Sodio - 1 e- 11 p+ Electrón 12 nº 11+ 101+ Na1+ Catión sodio IONES FORMADOS Cloro + 1 e- 17 p+ Electrón 18 nº 17+ 181- Cl1- Anión cloruro Actividades 1. Forma los iones correspondientes de los siguientes átomos. Nómbralos. a. b. c. d. e. Fósforo Sodio Berilio Aluminio Azufre