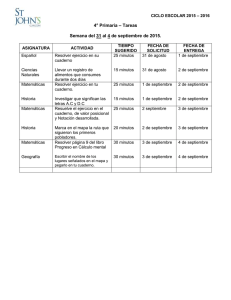
Cronogramas II Lapso 2015-2016 3er y 4to año
Anuncio
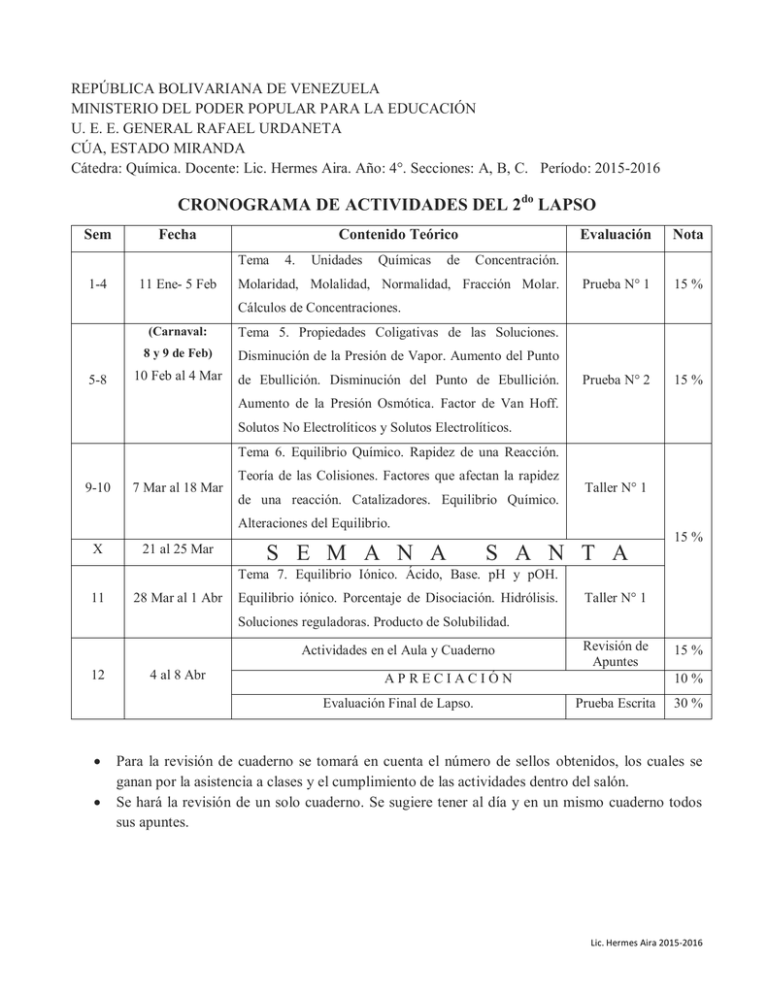
REPÚBLICA BOLIVARIANA DE VENEZUELA MINISTERIO DEL PODER POPULAR PARA LA EDUCACIÓN U. E. E. GENERAL RAFAEL URDANETA CÚA, ESTADO MIRANDA Cátedra: Química. Docente: Lic. Hermes Aira. Año: 4°. Secciones: A, B, C. Período: 2015-2016 CRONOGRAMA DE ACTIVIDADES DEL 2do LAPSO Sem Fecha Contenido Teórico Tema 1-4 11 Ene- 5 Feb 4. Unidades Químicas de Evaluación Nota Prueba N° 1 15 % Prueba N° 2 15 % Concentración. Molaridad, Molalidad, Normalidad, Fracción Molar. Cálculos de Concentraciones. 5-8 (Carnaval: Tema 5. Propiedades Coligativas de las Soluciones. 8 y 9 de Feb) Disminución de la Presión de Vapor. Aumento del Punto 10 Feb al 4 Mar de Ebullición. Disminución del Punto de Ebullición. Aumento de la Presión Osmótica. Factor de Van Hoff. Solutos No Electrolíticos y Solutos Electrolíticos. Tema 6. Equilibrio Químico. Rapidez de una Reacción. 9-10 7 Mar al 18 Mar Teoría de las Colisiones. Factores que afectan la rapidez de una reacción. Catalizadores. Equilibrio Químico. Taller N° 1 Alteraciones del Equilibrio. X 21 al 25 Mar 15 % S E M A N A S A N T A Tema 7. Equilibrio Iónico. Ácido, Base. pH y pOH. 11 28 Mar al 1 Abr Equilibrio iónico. Porcentaje de Disociación. Hidrólisis. Taller N° 1 Soluciones reguladoras. Producto de Solubilidad. Actividades en el Aula y Cuaderno 12 4 al 8 Abr APRECIACIÓN Evaluación Final de Lapso. Revisión de Apuntes 15 % 10 % Prueba Escrita 30 % Para la revisión de cuaderno se tomará en cuenta el número de sellos obtenidos, los cuales se ganan por la asistencia a clases y el cumplimiento de las actividades dentro del salón. Se hará la revisión de un solo cuaderno. Se sugiere tener al día y en un mismo cuaderno todos sus apuntes. Lic. Hermes Aira 2015-2016 REPÚBLICA BOLIVARIANA DE VENEZUELA MINISTERIO DEL PODER POPULAR PARA LA EDUCACIÓN U. E. E. GENERAL RAFAEL URDANETA CÚA, ESTADO MIRANDA Cátedra: Química. Docente: Lic. Hermes Aira. Año: 3°. Sección: D. Período: 2015-2016 CRONOGRAMA DE ACTIVIDADES DEL 2er LAPSO Sem 1-4 Fecha 11 Ene- 5 Feb (Carnaval: 8 y 9 de Feb) 10 Feb al 4 Mar 5-10 7 Mar al 18 Mar X 11 21 al 25 Mar 28 Mar al 1 Abr Contenido Teórico TEMA 5: COMPUESTOS QUÍMICOS. Reglas IUPAC para la nomenclatura y formulación de compuestos inorgánicos: Formación de Óxidos Básicos, Óxidos Ácidos o Anhídridos, Hidróxidos o Bases, Ácidos Hidrácidos, Ácidos Oxácidos, Sales Binarias (Haloideas) y Sales Ternarias (Oxisales). Nomenclatura Tradicional, Sistemática, Stock. TEMA 6: REACCIONES Y ECUACIONES QUÍMICAS. Diferencias entre ecuación y reacción química. Nomenclatura y formulación de ecuaciones químicas. Condiciones de reacción. Concepto de mol, Número de Avogadro, masa atómica y masa molecular. Relación entre masa – moles - número de partículas. Balanceo de ecuaciones por tanteo. Tipos de Cambios Químicos: reacciones de Combinación, Desplazamiento, Descomposición (térmica, electrólisis, fotoquímica, entre otras) y Doble Descomposición (neutralización, metátesis de sales, entre otras). S E M A N A 4 al 8 Abr TEMA 7: RELACIONES ESTEQUIOMÉTRICAS. Balanceo de Ecuaciones. Cálculos Estequiométricos. Reactivo Limitante. Rendimiento. Reacciones Endotérmicas y Exotérmicas. Laboratorio Prueba N° 1 15 % Taller N° 1 10 % Prueba N° 2 10 % Informe 15 % Revisión de Apuntes 10 % APRECIACIÓN Evaluación Final de Lapso. Nota S A N T A Actividades en el Aula y Cuaderno 12 Evaluación 10 % Prueba Escrita 30 % Para la revisión de cuaderno se tomará en cuenta el número de sellos obtenidos, los cuales se ganan por la asistencia a clases y el cumplimiento de las actividades dentro del salón. Se hará la revisión de un solo cuaderno. Se sugiere tener al día y en un mismo cuaderno todos sus apuntes. Lic. Hermes Aira 2015-2016