el agua apuntes
Anuncio
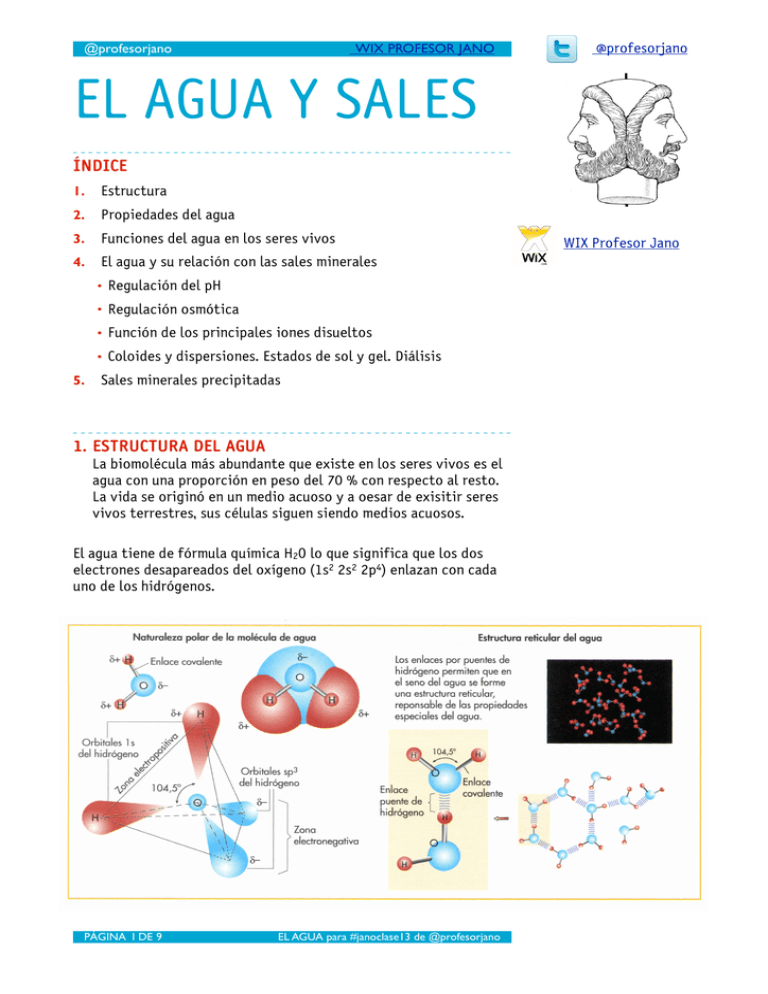
@profesorjano WIX PROFESOR JANO @profesorjano EL AGUA Y SALES ÍNDICE 1. Estructura 2. Propiedades del agua 3. Funciones del agua en los seres vivos 4. El agua y su relación con las sales minerales • Regulación del pH • Regulación osmótica • Función de los principales iones disueltos • Coloides y dispersiones. Estados de sol y gel. Diálisis 5. Sales minerales precipitadas 1. ESTRUCTURA DEL AGUA La biomolécula más abundante que existe en los seres vivos es el agua con una proporción en peso del 70 % con respecto al resto. La vida se originó en un medio acuoso y a oesar de exisitir seres vivos terrestres, sus células siguen siendo medios acuosos. El agua tiene de fórmula química H2O lo que significa que los dos electrones desapareados del oxígeno (1s2 2s2 2p4) enlazan con cada uno de los hidrógenos. PÁGINA 1 DE 9 EL AGUA para #janoclase13 de @profesorjano WIX Profesor Jano @profesorjano WIX PROFESOR JANO El oxígeno es un elemento mucho más electronegativo que el hidrógeno. Por este motivo los electrones compartidos en los enlaces covalentes están más próximos al oxígeno generando una región de densidad de carga negativa en esa zona mientras que en las regiones ocupadas por el hidrógeno la densidad de carga será positiva. Esat asimetría de carga en una molécula con una región de positiva y otra negativa, aunque la carga neta sea cero, es una propiedad que recibe el nombre de polaridad. Los puentes de hidrógeno son enlace intermoleculares que unen un átomo de hidrógeno unido a un elemento muy electronegativo con ese átomo electronegativo de otra molécula. Este enlace es una fuerza de atracción electrostática entre el hidrógeno positivo y, en el caso del agua, y el oxígeno negativo de otra molécula. También se pueden encontrar en el amoniaco (NH2) y diversas funciones orgáncias como grupos alcohol, ácido o amino. Una molécula de agua puede llegar a formar puentes de hidrógeno hasta con otras cuatro moléculas de agua, 2. PROPIEDADES DEL AGUA Video sobre disolución de una sal Las propiedades del agua se derivan de su polaridad y de la capacidad de producir puentes de hidrógeno. Estas propiedades son: - El agua posee un elevado calor específico y calor latente de vaporización (cantidades de calor para que una unidad de masa de agua eleve su temperatura un grado o bien cambie de líquido a vapor). Gracias a esta propiedad derivada de la presencia de puentes de hidrógeno el agua se mantiene en estado líquido entre 0 y 100 C - Es un buen disolvente de sustancias polares, llamadas también hidrófilas por este motivo. La disolución consiste en que las moléculas de agua rodean a las moléculas de la sustancia que se está disolviendo separando unas de otras. -El agua alcanza su máximo de densidad a 4oC, razón por la cual el hielo flota sobre el agua. -Tiene una elevada tensión superficial. Esta magnitud física mide la dificultad para estirar o romper la superficie de un líquido. -Presenta fuerzas de adhsesión (las moléculas de agua se adhieren a superficies, “moja”) y cohesión (las moléculas de agua están unidad unas a otra) altas. PÁGINA 2 DE 9 EL AGUA para #janoclase13 de @profesorjano @profesorjano WIX PROFESOR JANO 3. FUNCIONES BIOLÓGICAS DEL AGUA Gracias sus propiedades el agua desempeña funciones vitales en los seres vivos. las más destacables son: - Termorregulación: debido su elevado calor latente de vaporización y específico. El agua es capaz de absorber muchos julios sin variar demasiado su temperatura y también absorbe mucho calor al pasar de líquido a vapor refrigerando así la superficie de la que toma ese calor. Este es el sentido biológico del sudor de mucho mamífero o de la saliva en otros animales como el perro o el cocodrilo. El alcohol etílico tiene un calor específico de 0’6 cal/g.oC, es decir, sólo se requieren 0’6 calorías para elevar 1oC la temperatura de 1 gramos de etanol. El valor de Ce del agua es 1 - Medio de realización de las reacciones bioquímicas. Gracias a que es un buen disolvente de sustancias polares e iones, el agua ofrece un medio en el cual se lleven a cabo las reacciones bioquímicas de la actividad celular. Además su interacción con moléculas hidrofóbicas como los fosfolípidos permite la creación de compartimentos en los que las reacciones químicas son más eficientes. - Permite la vida en lugares con temperaturas inferiores a los 0oC. Cuando el agua se congela, en vez de hundirse queda en la superficie aislando el agua que queda por debajo de las temperaturas bajo cero del medio exterior impidendo así que se congele en su totalidad. Gracias a esto puede haber agua en las regiones árticas y antárticas y en zonas altas. - En relación con las sales minerales disueltas permite la homeostasis, es decir, la constancia de parámetros vitales de modo que sean compatibles con la vida como el pH y la presión osmótica. (la termorregulación también es otra función del agua en relación con la homeostasis). Material multimedia sobre el agua Documento distinción moléculas polares y apolares - Capilaridad: es una consecuencia de las elevadas fuerzas de cohesión de las moléculas de agua. Es un fenómeno gracias al cual las moléculas de agua ascienden espontáneamente por tubos muy estrechos. Esta característica contribuye al ascenso de la savia bruta por los estrechos vasos del xilema en las plantas. - Algunos animales como el zapatero (Gerris lacustris) pueden desplazarse sobre el agua gracias a su elevada tensión superficial. - Interviene en muchas reacciones como reactivo y como producto como por ejemplo en las reacciones de hidrólisis. Agua: propiedaes y funciones PÁGINA 3 DE 9 EL AGUA para #janoclase13 de @profesorjano @profesorjano WIX PROFESOR JANO Existen muchas moléculas que a pesar de ser hidrófilas no se disuelven en agua debido a su elevado peso molecular como es el caso, por ejemplo, de las fibras de celulosa. Estas macromoléculas quedan en suspensión estable en el medio acuoso generando lo que se llama coloides. 4. EL AGUA Y SU RELACIÓN CON LAS SALES MINERALES Las sales minerales constituyen el otro grupo de biomoléculas inorgánicas. las sales solubles y otros electrolitos generan espontáneamente iones tras su disolución que desempeñan funciones vitales en los seres vivos tal y como se verá más adelante. El ph y la acidez El agua tiene un pequeñísimo grado de ionización que consiste en que parte de las moléculas de H2O han cedido un protón (H+) a otra molécula de agua quedando ellas como OH- y las que han recibido el protón como H3O+. La acidez de un medio viene dada por la [H3O+] de modo que cuanto mayor sea esta concentración mayor será su acidez. En el caso del agua destilada [H3O+] es 10-7. La acidez se mide mediante una magnitud llamada pH que es pH = - Log [H3O+] Para el agua, el pH = - Log 10-7 = 7 que es considerado un pH neutro. Para valores mayores de [H3O+] (exponentes -6, -5, ....) el pH será menor que siete y el medio es ácido y para valores menores de [H3O+] que 10-7 (exponentes -8,-9,...) el medio será básico. Las sustancias disueltas en agua alteran el pH que debe mantenerse en unos márgenes muy estrechos y cercano a 7 para que sea compatible con la via. Por ejemplo, una pequeña variación puede alterar drásticamente la actividad de las proteínas. Por este motivo la constancia del pH es fundamental para los seres vivos. Las células y los organismos mantienen un pH citosólico específico y constante gracias a unas sales disueltas que forman disoluciones que son capaces de amortiguar estas variaciones. Estas disoluciones están formadas por mezclas de ácidos débiles y sus bases conjugadas (se verá en el tema de ácidos y bases de química). Estas disoluciones se denominan amortiguadoras, tampones o buffers. Los tampones biológicos más importantes en el ser humano son el sistema fosfato y bicarbonato. Sistema tampón fosfato Actúa en el citoplasma de las células (medio intracelular) y su capacidad de amortiguación de pH está en un intervalo entre 5’9 y PÁGINA 4 DE 9 EL AGUA para #janoclase13 de @profesorjano @profesorjano WIX PROFESOR JANO 7’9 lo que cubre con creces las necesidades de los sistemas biológicos cuyo pH debe oscilar entre 6’9 y 7’4. El tampón fosfato forma el siguiente equilibrio: H2PO4- + H2O <---> H3O+ + HPO42Cuando el pH disminuye (la acidez aumenta y la [H3O+] también) se consumen los H3O+]reaccionando con el HPO42- . De este modo se contrarresta el aumento de [H3O+]. Si el pH aumenta, se disocia más H2PO4- produciendo más H3O+ que neutralizará la subida del pH. Sistema bicarbonato Es el sistema de tamponamiento del pH que se encuentra en el plasma sanguíneo. En este caso el equilibrio se produce entre el ácido carbónico (trioxocarbonato (IV) de hidrógeno), dador de protones, y el ion bicarbonato [hidrógenotrioxocarbonato (IV)], aceptor de protones. H2CO3 + H2O <---> H3O+ + HCO3En realidad el H2CO3 que hay en el plasma sanguíneo se forma a partir del CO2 disuelto lo que hace al sistema químico más complejo (CO2 + H2O <---> H2CO3) ya que en realidad intervienen dos equilibrios. El pH de la sangre tiene habitualmente un valor de 7’4. En algunas situaciones patológicas como la diabetes grave no controlada se produce una sobredosis de ácidos metabólicos que hace que el pH de la sangre pueda bajar a 6’8 a pesar del sistema de tamponamiento. La homeostasis del pH es un factor fundamental para el mantenimiento de la vida. Por eso, aquellos impactos contaminantes que alteran el pH como la lluvia ácida son tan graves para el medio ambiente. La regulación osmótica La ósmosis es un movimiento de agua (disolvente) desde una disolución de concentración menor (hipotónica) a otra de concentración mayor (hipertónica) cuando ambas están separadas por una membrana semipermeable. El agua se mueve gracias a diferencia de presión osmótica que hay entre una disolución concentrada (mayor) que atrae al disolvente desde una disolución más diluida (menor presión osmótica). La presión osmótica es directamente proporcional a la concentración de la disolución. PÁGINA 5 DE 9 EL AGUA para #janoclase13 de @profesorjano (Una persona no puede vivir más de unos minutos si su pH sanguíneo supera el valor de 7’6 o disminuye por debajo de 7) @profesorjano (Cuando dos disoluciones tienen igual concentración se dice que son isotónicas) WIX PROFESOR JANO Cuando se introduce una célula en un medio hipotónico entrará agua a su interior y la célula reviente. Por el contrario, si se introduce en un medio hipertónico la célula perderá agua y se arrugará y deshidratará. Es evidente que estas situaciones no son compatibles con la vida por lo que la homeostasis de la presión osmótica, la osmorregulación, es otro factor vital para el mantenimiento de la vida. A lo largo de la evolución, los seres vivos han desarrollado diversas estrategias para evitar catástrofes osmóticas. Las células vegetales, las moneras, hongo y muchos protoctistas han desarrollado una pared celular rígida y no expandible con resistencia suficiente para resistir la presión osmótica y evitar que la célula explote al encontrarse en medios hipotónicos. Por la tanto la célula sólo se hincha estado que se denomina turgencia. Gracias a la turgencia las plantas pueden conseguir rigidez mecánica. Animación 1 ósmosis Animación 2 ósmosis Cuando una célula vegetal se introduce en un medio hipertónico, por ejemplo agua de mar, pierden agua y la membrana celular que estaba pegada a la apred celular se contrae pero algunos fragmentos quedan adheridos a la pared celular rompiéndose la célula. Por el contrario las células animales en un medio hipotónico explotan irremisiblemente al no tener pared celular fenómeno que recibe el nombre de plasmolisis (hemolisis, en el caso de células sanguíneas). La única solución posible para las células animales es mantener isotónicos los medios intracelulares y extracelulares mediante diversos sistemas. PÁGINA 6 DE 9 EL AGUA para #janoclase13 de @profesorjano @profesorjano WIX PROFESOR JANO - A nivel celular mediante sistemas de bombeos de iones que igualen las concentraciones de los dos medios así como la regulación de la concentración de determinadas proteinas como albúminas que también contribuyen a regular las concentraciones de soluto con su mayor o menor presencia. - A nivel orgánico, los animales desarrollan sistemas para controlar la cantidad de agua que permanece en el organismo y también la cantidad de sales. Estos sistemas son los sistemas excretores que generan orina junto con glándulas que tienen algunas especies y que son capaces de secretar sales. En un medio hipertónico las células animales se arrugan y deshidatan. Los azúcares se almacenan en forma de polisacáridos porque generan presiones osmóticas compatibles con valores vitales. Por ejemplo 1 gramo un polisacárido tiene el mismo efecto osmótico que un miligramo de glucosas sueltas. Función los principales iones y sales disueltas Mineral Localización función Otras características Fe Mioglobina - Hemoglobina HIERRO Almacenamiento y transporte oxígeno Se encuentra en carnes, vísceras (hígado), pescados, aves y en algunas legumbres y verduaras. En el organismo existen entre 3 y 5 gramos de hierro: el 60 % en la hemoglobina y el 40 % en la ferritina y hemosiderina, proteínas que lo almacenan en el hígado. Cu COBRE F FLÚOR Co COBALTO PÁGINA 7 DE 9 Interviene en la síntesis de Abundante en mariscos (ostras), vísceras y la hemoglobina frutos y legumbres secas. El 90 % está ubicado en músculos, huesos e hígado. Cu2+. Se encuentra en dientes, huesos, plasma, piel y tiroides. Proporciona resistencia a la caries dental y en cantidades moderadas mejora la osteoporosis. Se localiza en el agua fluorada, alimentos marinos y té. No se debe consumir más de 4 miligramos al día. Forma parte de la Vitamina B12 que interviene en la hematopoyésis Es abundante en órganos y músculos de animales. Se encuentra fundamentalmente almacenada en el hígado La carencia de vitamina B12 produce la anemia perniciosa Su metabolismo es modificado negativamente por la toma prolongada de corticoides y tranquilizantes. Su ion es F-. EL AGUA para #janoclase13 de @profesorjano @profesorjano WIX PROFESOR JANO Mineral Localización función Otras características Zn Se localiza en músculos, ojos, piel y próstata. Es cofactor de más de 100 enzimas Sus fuentes naturales son las ostras, carnes, huevos, pescados y cereales integrales. Interviene en la movilización de la vitamina A. Su ion es Zn2+. Interviene el metabolismo de carbohidratos y lípidos. También es abundante en ostras, hígado, patatas, cereales y levaduras de cerveza. La deficiencia de cromo en la dieta puede provocar intolerancia a la glucosa. CINC Cr CROMO Mn MANGANESO I IODO Ca CALCIO Na, K, Cl Potasio Sodio Se encuentra en enzimas, hueso e interviene en el crecimiento y reproducción Se encuentra en nueces, cereales, integrales, legumbres, té y verduras. Mn2+. El iodo forma parte de las hormonas tiroideas (tiroxina - T4 y triyodotironina T3) Es especialmente abundante en alimentos que proceden del mar (mariscos, pescados y algas). Es abundante en los huesos que es su reservorio para el organismo. Interviene en la coagulación y la contracción muscular Su fuente natural son los productos lácteos. Forma parte de la sustancia intercelular del tejido óseo. También actúa como segundo mensajero en el sistema de transducción de señales. Su ion es Ca2+. Son los iones que intervienen en la generación del potencial de membrana e impulso nervioso La sal común es la fuente principal de estos iones. El organismo humano contiene 20 a 25 mg de I, encontrándose y entre el 70 y 80 % se localiza en el tiroides. Su ion es I-. Las formas iónicas son Na+, K+, Cl-. Cloro Mg MAGNESIO Forma parte de la molécula de Además, también es un componente fundamental clorofila en la sustancia intercelular del tejido óseo. El ion es Mg2+. Coloides. Estados de Sol y Gel. Dialisis Como ya se ha mencionado anteriormente, la difeencia entre una disolución y una dispersión coloidal (coloide) es el diametro de los solutos. Cuando estos solutos son macromoléculas de un diámetro que oscila entre 10-7 y 2.10-5 cm, por ejemplo proteínas, polisacáridos o ácidos nucleicos, forman dispersiones coloidales que PÁGINA 8 DE 9 EL AGUA para #janoclase13 de @profesorjano @profesorjano WIX PROFESOR JANO se caracteerizan porque las partículas quedan en suspensión. Estas partículas en suspensión pueden adquirir dos estados físicos: • Sol: cuando el coloide tiene un aspecto líquido y es debido en el que los solutos coloidales no están en mucha cantidad. • Gel: cuando el coloide tiene un aspecto de gel sólido o semisólido. En este caso la proporción de soluto es mucho mayor que la de disolvente. Por ejemplo, forman geles, dispersiones coloidales de colágeno y de pectinas. Las partículas en suspensión de un coloide pueden sedimentar mediante centrifugación. De hecho, este sistema se utiliza para separar distintos componentes de un coloide ya que según su tamaño sedimentan antes o después según las rpm (revoluciones por minuto) de la centrifugadora. De este modo las sustancias más grandes quedarán en el fondo del precipitado y las más ligeras en la superficie del precipitado. La diálisis es un proceso de separación de los solutos de un coloide en función del tamaño. Se consigue haciendo pasar la dispersión coloidal por membranas semipermeables con poros de diferentes diámetros. 5. LAS SALES MINERALES PRECIPITADAS Las sales forman piezas duras, más o menos rígidas, que suelen ser el esqueleto externo o interno de muchos organismos. Es el caso, por ejemplo, de los huesos de los vertebrados - compuestos de carbonato de calcio y fosfato de calcio-, de las conchas de los moluscos carbonato de calcio-, los otolitos también formados por carbonato de calcio o de las cubiertas de las diatomeas contituidas por sales de sílice. PÁGINA 9 DE 9 EL AGUA para #janoclase13 de @profesorjano