HIBRIDACIÓN Cuando un átomo de carbono se combina con otros
Anuncio
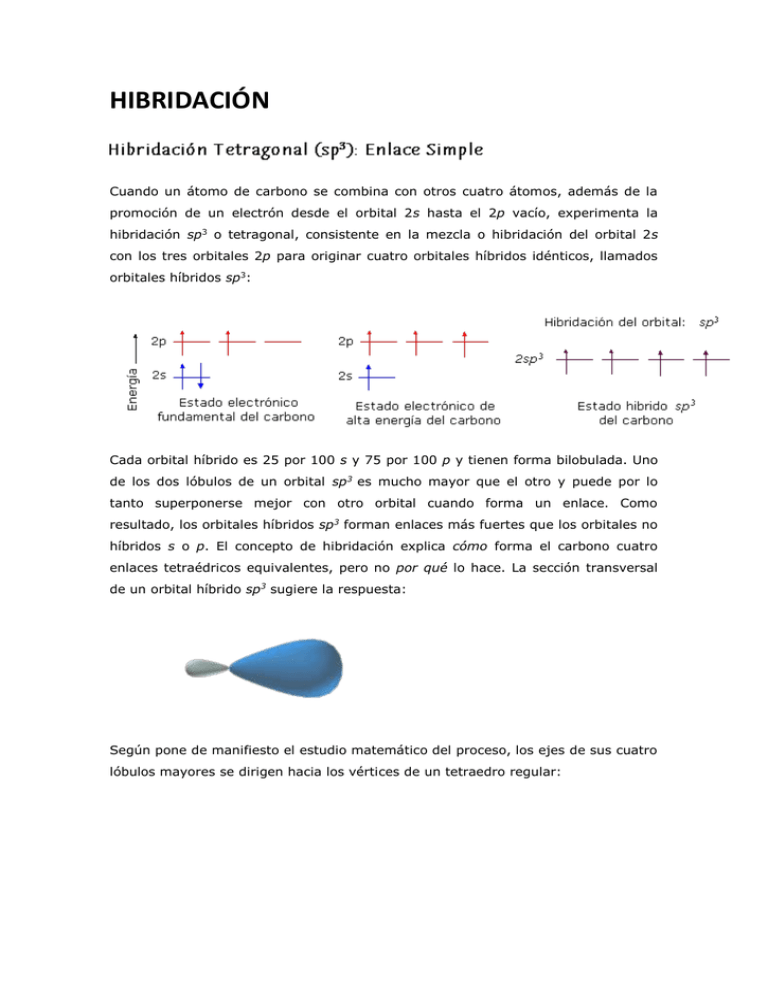
HIBRIDACIÓN Cuando un átomo de carbono se combina con otros cuatro átomos, además de la promoción de un electrón desde el orbital 2s hasta el 2p vacío, experimenta la hibridación sp3 o tetragonal, consistente en la mezcla o hibridación del orbital 2s con los tres orbitales 2p para originar cuatro orbitales híbridos idénticos, llamados orbitales híbridos sp3: Cada orbital híbrido es 25 por 100 s y 75 por 100 p y tienen forma bilobulada. Uno de los dos lóbulos de un orbital sp3 es mucho mayor que el otro y puede por lo tanto superponerse mejor con otro orbital cuando forma un enlace. Como resultado, los orbitales híbridos sp3 forman enlaces más fuertes que los orbitales no híbridos s o p. El concepto de hibridación explica cómo forma el carbono cuatro enlaces tetraédricos equivalentes, pero no por qué lo hace. La sección transversal de un orbital híbrido sp3 sugiere la respuesta: Según pone de manifiesto el estudio matemático del proceso, los ejes de sus cuatro lóbulos mayores se dirigen hacia los vértices de un tetraedro regular: Esta hibridación, típica de todos los átomos de carbono unidos a otros cuatro átomos cualesquiera, supone la situación más perfecta para que el solapamiento de cada uno de los cuatro orbitales híbridos con el correspondiente orbital de los átomos unidos al átomo de carbono tetraédrico sea máxima. Ello es debido a que la forma tetraédrica supone la mayor distancia posible entre los cuatro orbitales híbridos y, por tanto, entre los cuatro enlaces covalentes resultantes, con lo que sus repulsiones mutuas serán mínimas y el solapamiento o interpenetración mayor. Con ello, de acuerdo con el principio de Pauling de que a mayor solapamiento corresponde mayor fuerza del enlace, los enlaces resultantes son muy fuertes y estables. Metano El metano, el hidrocarburo saturado más sencillo, de fórmula molecular CH 4, consiste en un átomo de carbono con hibridación sp3 que solapa sus cuatro orbitales híbridos con los orbitales s de cuatro átomos de hidrógeno para formar cuatro enlaces fuertes carbono-hidrógeno. En el metano, cada enlace tiene energía de 104 kcal/mol (435 kJ/mol) y longitud de 1.10 Å. Dado que los cuatro enlaces tienen configuración geométrica específica, puede definirse una tercera propiedad importante denominada ángulo de enlace. El ángulo formado por cada HC-H es exactamente de 109.5º, el llamado ángulo tetraédrico. En las siguientes figuras se muestran los orbitales implicados solapándose y la molécula de metano en proyección de cuña: La proyección de cuña es uno de los métodos usuales para representar en el plano moléculas tetraédricas. Consiste en situar dos de los cuatro enlaces carbonohidrógeno en el plano de representación y esquematizados mediante rayas de trazo normal. Los otros dos enlaces carbono-hidrógeno, que quedan uno por delante del plano formado por el átomo de carbono y los dos átomos de hidrógeno anteriores y el otro por detrás de ese plano, se representan con un trazo grueso en forma de cuña el primero y con un trazo discontinuo, también en forma de cuña, el segundo. El metano tiene, por consiguiente, forma tetraédrica con el átomo de carbono en el centro del tetraedro y los átomos de hidrógeno en sus vértices. Esta situación se da en todos los demás compuestos orgánicos con átomos de carbono unidos a otros cuatro átomos porque siempre que un átomo de carbono esté enlazado a otros cuatro átomos tendrá hibridación sp3. En los átomos de carbono de los compuestos orgánicos son posibles otros tipos de hibridación. En la hibridación sp2 o trigonal la mezcla o hibridación tiene lugar únicamente entre el orbital s y dos orbitales p, quedando el tercer orbital p sin hibridar. Cada orbital híbrido es 33 por 100 s y 67 por 100 p. Los tres orbitales híbridos se encuentran en el mismo plano formando ángulos de 120º entre sí, con el orbital p restante perpendicular al plano sp2 , como se muestra a continuación: Esta hibridación, como se verá en algún ejemplo a continuación, es típica en los átomos de carbono unidos a otros tres átomos, a uno de ellos con un doble enlace. Etileno El etileno, C2H4, es el alqueno más sencillo. Posee dos átomos de hidrógeno menos que el etano, por lo que cada carbono sólo está unido al otro carbono y a dos átomos de hidrógeno. Su estructura se explica admitiendo la hibridación sp2 para sus átomos de carbono. Cada carbono utiliza uno de los orbitales híbridos que posee para formar un enlace con el otro y los dos restantes para solaparse con los orbitales s de dos átomos de hidrógeno, formándose así cuatro orbitales moleculares carbono-hidrógeno. La molécula de etileno consta, por tanto, de cinco enlaces fuertes de tipo , uno carbono-carbono y cuatro carbono-hidrógeno: Como consecuencia de esta hibridación, los seis átomos de la molécula pueden situarse en el mismo plano, tal como se ha representado. Pero a esta planaridad contribuye también el orbital p sin hibridar que queda en cada átomo de carbono. Como los ejes de los lóbulos de estos dos orbitales son perpendiculares el plano de los orbitales híbridos, quedan formando un ángulo de 90º por encima y debajo del plano de la molécula y pueden solaparse lateralmente para formar un enlace entre los dos átomos de carbono: El solapamiento lateral de los orbitales p y, por consiguiente, la formación del enlace sólo es posible si permanecen paralelos, por lo que necesariamente la molécula tiene que ser plana para poseer la estabilidad que aporta el enlace . Según este modelo, los dos enlaces que unen a los dos átomos de carbono no son iguales; uno es de tipo , originado por solapamiento frontal de dos orbitales híbridos sp2 el otro es de tipo , más débil, debido a que el solapamiento lateral es menos perfecto y menor que el frontal. Todos los dobles enlaces de los alquenos tienen la misma estructura que la expuesta para el etileno. La molécula de etileno que resulta tiene estructura planar con ángulos de enlace HC-H y H-C-C aproximados de 120º (los ángulos H-C-H miden 116º, y los ángulos HC-C, 121.7º). Cada enlace C-H tiene longitud de 1.076 Å y energía de 3 kcal/mol (431 kJ/mol). Podría esperarse que el doble enlace central carbono-carbono del etileno fuera más corto y más fuerte que el enlace sencillo del etano, porque resulta de compartir cuatro electrones en lugar de dos. Esta predicción se ha confirmado, ya que el etileno tiene longitud de enlace C-C de 1.33 Å y energía de 152 kcal/mol (636 kJ/mol), frente a 1.54 Å y 88 kcal/mol, respectivamente, para el etano. Obsérvese sin embargo que la energía del doble enlace carbono-carbono no es exactamente el doble de la que presenta el enlace sencillo C-C, debido a que la superposición en la parte π del doble enlace no es tan efectiva como en la parte σ. La estructura del etileno se presenta en la figura siguiente: Finalmente, el tercer tipo de hibridación que puede experimentar un átomo de carbono en sus combinaciones, es la hibridación sp o digonal, consistente en la hibridación del orbital s con sólo uno de sus tres orbitales p. Cada orbital híbrido es 50 por 100 s y 50 por 100 p. En este caso, los dos orbitales híbridos resultantes, que son como en las hibridaciones anteriores también bilobulados, se orientan en línea recta, formando un ángulo de 180º, quedando los dos orbitales p sin hibridar formando ángulos de 90º entre sí y con el eje de los dos orbitales híbridos sp: Esta hibridación es la típica de los átomos de carbono unidos a otros dos átomos, bien con sendos dobles enlaces o bien con un triple enlace a uno de ellos y con uno sencillo al otro. Acetileno El acetileno, C2H2, es el alquino más sencillo. Posee dos átomos de carbono con hibridación sp enlazados entre sí y cada uno a un átomo de hidrógeno. Estas uniones, según la teoría del enlace de valencia, se producen a través de los solapamientos de los dos orbitales híbridos de cada carbono entre sí y con los orbitales s de dos átomos de hidrógeno que originan tres enlaces fuertes , uno carbono-carbono y dos carbono-hidrógeno, quedando los cuatro átomos alineados en línea recta. Pero además, cada átomo de carbono posee otros dos orbitales p sin hibridar cuyos ejes son perpendiculares entre sí y con el eje de los dos orbitales híbridos, y como en el caso del etileno, pueden solaparse lateralmente para originar dos orbitales moleculares , cuyos cuatro lóbulos (dos de cada orbital) envuelven prácticamente a los dos átomos de carbono, que quedan así enlazados por un triple enlace formado por un enlace fuerte y dos más débiles . Debido a la hibridación sp, el acetileno es una molécula lineal con ángulos de enlace H-C-C de 180º. Su enlace carbono-hidrógeno tiene longitud de 1.06 Å, y su energía es de 125 kcal/mol (523 kJ/mol). La longitud del enlace carbono-carbono es de 1.20 Å, y su energía es de 200 kcal/mol (837 kJ/mol), de modo que el triple enlace del acetileno es más corto y más fuerte de todos los enlaces C-C. La estructura del acetileno se presenta en la figura siguiente: A continuación se comparan las hibridaciones sp, sp2, y sp 3.