fuentes de radicales libres de oxígeno
Anuncio
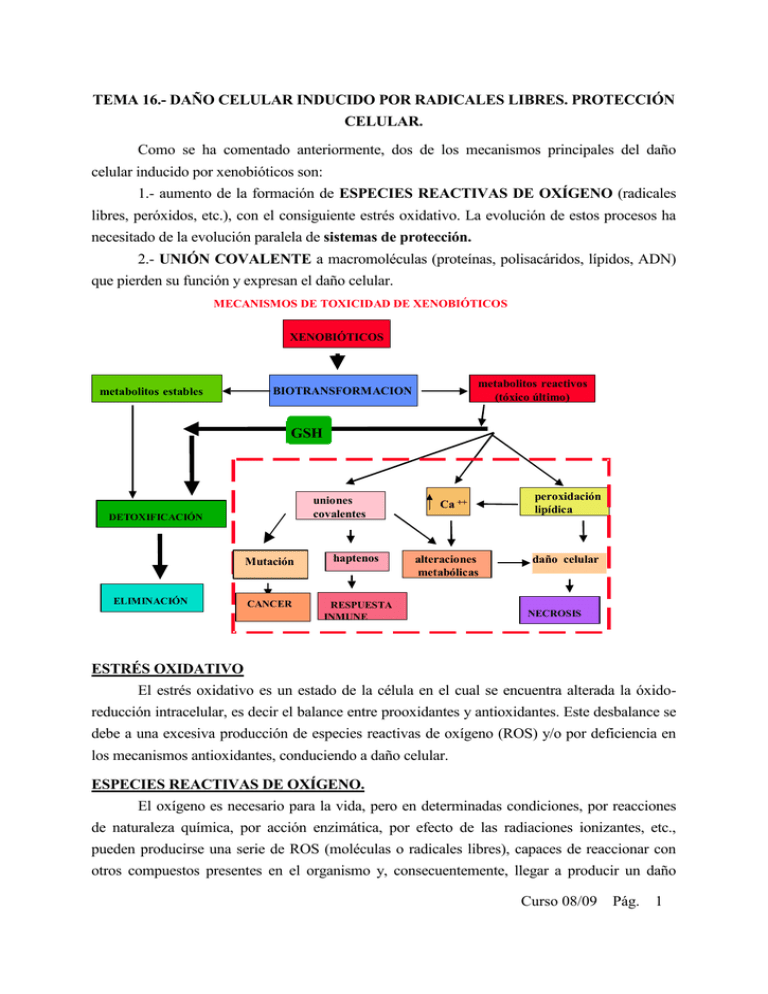
TEMA 16.- DAÑO CELULAR INDUCIDO POR RADICALES LIBRES. PROTECCIÓN CELULAR. Como se ha comentado anteriormente, dos de los mecanismos principales del daño celular inducido por xenobióticos son: 1.- aumento de la formación de ESPECIES REACTIVAS DE OXÍGENO (radicales libres, peróxidos, etc.), con el consiguiente estrés oxidativo. La evolución de estos procesos ha necesitado de la evolución paralela de sistemas de protección. 2.- UNIÓN COVALENTE a macromoléculas (proteínas, polisacáridos, lípidos, ADN) que pierden su función y expresan el daño celular. MECANISMOS DE TOXICIDAD DE XENOBIÓTICOS XENOBIÓTICOS metabolitos estables metabolitos reactivos (tóxico último) BIOTRANSFORMACION GSH uniones covalentes DETOXIFICACIÓN ELIMINACIÓN Mutación haptenos CANCER RESPUESTA INMUNE Ca ++ alteraciones metabólicas peroxidación lipídica daño celular NECROSIS ESTRÉS OXIDATIVO El estrés oxidativo es un estado de la célula en el cual se encuentra alterada la óxidoreducción intracelular, es decir el balance entre prooxidantes y antioxidantes. Este desbalance se debe a una excesiva producción de especies reactivas de oxígeno (ROS) y/o por deficiencia en los mecanismos antioxidantes, conduciendo a daño celular. ESPECIES REACTIVAS DE OXÍGENO. El oxígeno es necesario para la vida, pero en determinadas condiciones, por reacciones de naturaleza química, por acción enzimática, por efecto de las radiaciones ionizantes, etc., pueden producirse una serie de ROS (moléculas o radicales libres), capaces de reaccionar con otros compuestos presentes en el organismo y, consecuentemente, llegar a producir un daño Curso 08/09 Pág. 1 celular. Un radical libre (RL) es aquella especie química, cargada o no, que tiene en su estructura al menos un electrón desapareado. Los RL son muy peligrosos porque son muy inestables y, por tanto, tienen una vida media muy corta (tienden a aparearse robando electrones). Los radicales libres de oxígeno (RLO) se pueden generar a nivel intra o extra celular. Una de las principales fuentes es la cadena respiratoria. FUENTES DE RADICALES LIBRES DE OXÍGENO EXTRACELULARES - Humo de cigarrillos Luz solar Oxidación de drogas (CCl4) Radiaciones ionizantes Shock térmico Sustancias cíclicas de naturaleza redox (paraquat) INTRACELULARES - Transporte de electrones mitocondrial - Reacciones del complejo citocromo P450 en RE (metabolismo de xenobióticos) - Metabolismo de ácidos grasos en los peroxisomas - NADPH oxidasa de membrana (especialmente en células inflamatorias) - Subproductos de R. enzimáticas (xantina oxidasa) - Células fagocíticas Las ROS más importantes son: a) Anión superoxido: O2 + e- b) Peróxido de hidrógeno: 2O2-. + 2H+ c) Radicales hidroxilo: H2O2 + O2-. O2-. H2O2 + O2 O2 + HO- + HO. Por otra parte, el H2O2 puede reaccionar con metales divalentes (libres o unidos a proteínas) y producir HO. vía reacción de Fenton. El ejemplo tipo con Fe++ libre, ocurre según la siguiente reacción: . H2O2 + Fe2+ Fe3+ + HO + HO Curso 08/09 Pág. 2 Muchos xenobióticos, directa o indirectamente, pueden causar estrés oxidativo como un componente de su toxicidad, al formar ROS parcialmente reducidos que son a su vez oxidantes muy reactivos y, consecuentemente, muy peligrosos. EJEMPLO. El citocromo c tiene una ruta de oxidación alternativa a la normal por acción del paraquat (herbicida bipiridilo hepatotóxico). Obsérvese la formación de radicales libres. O2 Citocromo c 2+2+) (Fe(Fe ) oxidasa H 2O Citocromo c 3+3+ (Fe(Fe )) DESTINO MOLECULAR DEL ESTRES OXIDATIVO Cuando las especies reactivas oxidantes superan las defensas antioxidantes se produce el estrés oxidativo, hay daño a macromoléculas. El posible destino celular bajo condiciones de estrés, dependerá de varios factores: el contenido endógeno de defensas antioxidantes, el grado de estimulación de las mismas bajo la condición de estrés, la reversibilidad de las modificaciones a macromoléculas producidas, la magnitud del estrés oxidativo y sus consecuencias funcionales. LOS COMPUESTOS CELULARES MÁS SENSIBLES a los efectos de estos oxidantes son: 1. Las proteínas 2. Los lípidos insaturados 3. Los ácidos nucleicos 4. Los carbohidratos. DESTINOS MOLECULARES DEL DAÑO OXIDATIVO Oxidación de proteínas grasos (enzimas, sistemas de transporte) Oxidación de ác. Nucleicos OXIDANTE Grupos de ácidos poliinsaturados (membranas) Oxidación de carbohidratos GSH antioxidantes Dienos conjugados Ac. Grasos hidroxilados Curso 08/09 Pág. 3 (mutaciones, (ácido hialurónico, pentano, etano. transformación) sistema inmune) A continuación, describiremos los daños por radicales libres que pueden sufrir estas moléculas. 1.- Proteínas. Las proteínas son modificadas de diferente manera por ROS. Estas, por ejemplo, a) Pueden reaccionar directamente con el ligando metálico de muchas metaloproteínas. Se ha comprobado que el hierro de la hemoglobina puede reaccionar con el radical superóxido o el peróxido de hidrógeno para formar metahemoglobina. Otra importante hemoproteína citoplasmática, la catalasa, es inhibida por el O2-., que la convierte en sus formas inactivas ferroxi y ferrilo. Por último, el peroxido de hidrógeno, también puede reducir el Cu2+ de la superóxido dismutasa CuZn a Cu1+, reaccionando después con él generando radical hidroxilo. A su vez, este radical hidroxilo, ataca un residuo adyacente de histidina del centro activo del enzima, necesario para la actividad catalítica. b) Debido a la reactividad de los radicales libres con las moléculas insaturadas o que contienen azufre, las proteínas con proporciones elevadas de Trp, Tyr, Phe, His, Met y Cys pueden sufrir modificaciones de aminoácidos mediadas por radicales libres. En este sentido se ha observado que enzimas tales como la gliceraldehido-3-fosfato deshidrogenasa o superoxido dismutasa, que dependen de estos aminoácidos para presentar su actividad, se inhiben en presencia de radicales libres. Las reacciones de los radicales libres con estos aminoácidos dan lugar también a alteraciones estructurales en las proteínas provocando entrecruzamientos y fenómenos de agregación, que se ven favorecidos por la formación de puentes disulfuro intra e intermoleculares. c) Los procesos de oxidación, pueden a su vez alterar la homeostasis del calcio, probablemente como consecuencia de una disminución en la actividad de la Calcio-ATPasa en las membranas plasmáticas secundaria a la oxidación de tioles esenciales en la proteína o por formación de aductos covalentes. Ello supone la alteración en los procesos en los que está implicado el calcio, como por ejemplo la contracción muscular, sistemas de transporte, etc., que dañan gravemente las células. d) Los enlaces peptídicos también son susceptibles de ser atacados por los radicales libres (proteolisis). Estos enlaces pueden romperse tras la oxidación de residuos de prolina por radicales hidroxilo o superóxido. e) Finalmente, la reacción de los radicales libres con las proteínas también puede generar subproductos que amplificarían el daño inicial. Un ejemplo lo constituye la oxidación del Trp hasta H2O2. 2.- Lípidos. Los radicales libres hidroxilo e hidroperoxilo pueden reaccionar con los ácidos grasos poliinsaturados (PUFA) de los fosfolípidos y de otros componentes lipídicos de las Curso 08/09 Pág. 4 membranas para formar hidroperóxidos que pueden alterar la estructura y función de las membranas. Los PUFA de las membranas celulares, son muy vulnerables a los ataques oxidativos por los RLO o por ROS, puesto que contienen grupos metileno separados por dobles enlaces que debilitan el enlace C-H metileno. Peroxidacion lipidica: Los fosfolípidos de membrana son muy accesibles para retirarles electrones. La peroxidación lipídica se puede estimular por agentes generadores de RLO durante su biorreducción, como es el caso del paraquat, ozono, Cl4C, óxidos de nitrógeno, sales de hierro, alcohol etílico, paracetamol, etc. (iniciación de la peroxidación lipídica). Los radicales, para completar su par electrónico, pueden reaccionar con otro radical (con lo cual ambos dejan de serlo, terminación de la peroxidación), o bien sustraer un electrón de otra molécula (por ejemplo, un PUFA), la cual se convierte entonces en un radical (fase de propagación). Así, cuando se origina el radical lipídico (iniciación), sufre inmediatamente un reajuste molecular produciéndose un dieno conjugado que puede reaccionar con el oxígeno y formar un radical peroxilo (propagación). Este radical puede formar de nuevo un radical libre lipídico y un hidroperóxido. Por tanto, una vez iniciada la peroxidación de lípidos, tiene lugar una reacción en cadena de producción de radicales libres que lleva a la formación de peróxidos orgánicos a partir de los PUFA propagándose el daño peroxidativo. Por su parte, el hidroperóxido, que es un compuesto estable, puede entrar en contacto con iones metálicos de transición, produciendo más radicales libres que iniciarán, y propagarán otras reacciones en cadena, o bien sufrir procesos de ruptura (ramificaciones). Los RLO formados con los componentes lipídicos de la membrana celular y mitocondrial son los causantes de algunos de los efectos citotóxicos observados, como por ejemplo, el aumento de hidrofilicidad de la membrana, lo que altera la estructura y función de la misma, inhibición enzimática, etc. (el efecto sobre los eritrocitos es la presencia de anemia y formación de metahemoglobina). Por último, los productos finales del proceso de peroxidación lipídica, entre los que se encuentran hidrocarburos volátiles, alcoholes o aldehidos, pueden difundir lejos del lugar donde se originaron y causar edema celular e influir en la permeabilidad vascular, inflamación y quimiotaxis. El malondialdehido, que es otro producto final de la peroxidación de ácidos grasos con tres o más dobles enlaces, puede causar entrecruzamientos y polimerización de distintos componentes de la membrana, alterando aún más sus propiedades. FASES DE LA PEROXIDACION LIPIDICA a) Iniciación: RH + Iniciador (OH.) R. + H2O b) Propagación: R. + O2 ROO. ROO. + RH ROOH + R. Curso 08/09 Pág. 5 c) Ramificaciones: d) Terminación: ROOH RO. + OH. 2ROOH ROO. + RO. + H2O ROO. + ROO. O2 + productos no radicales (ceto) RH = ácido graso insaturado OH. = radical hidroxilo R. = radical alilo RO. = radical alcoxilo ROO. = radical peroxilo ROOH = hidroperóxido 3.- Ácidos nucleicos. Los ácidos nucleicos también pueden ser atacados por los radicales libres. Realmente la citotoxicidad de estas especies químicas, en gran parte, es una consecuencia de las aberraciones cromosómicas producidas por las modificaciones químicas que sufren las bases y los azúcares del DNA al reaccionar con los radicales libres, especialmente con el radical hidroxilo, con consecuencias similares a las de los agentes carcinógenos. Las modificaciones químicas de los nucleótidos provocan, en muchos casos, la ruptura de las hebras del DNA. Si el daño que se origina es tan grande que no puede ser reparado, se produce una mutación, o bien, la célula muere. A continuación se muestra un esquema del daño causado en el ADN por los radicales libres de oxígeno (se verá con más detalle en el Tema 18). 4.- Carbohidratos. Los carbohidratos son dañados por los radicales libres en menor proporción que otras moléculas. Azúcares tales como glucosa, manitol o ciertos desoxiazúcares pueden reaccionar con el radical hidroxilo para producir sustancias reactivas. Asímismo, los polisacáridos pueden sufrir el ataque de los radicales libres, en este caso, fragmentándose a unidades más sencillas (despolimerización del ácido hialurónico). Curso 08/09 Pág. 6 PROTECCION CELULAR CONTRA LOS OXIDANTES Las células de mamíferos han desarrollado sistemas de protección para minimizar el daño resultante de la biotransformación de xenobióticos y productos oxidativos normales del metabolismo celular. Existen, al menos, cuatro mecanismos que contribuyen a aminorar los efectos perjudiciales de estos oxidantes en la célula. Los tres primeros de los citados son enzimáticos y el cuarto es no enzimático. DEFENSAS ENZIMÁTICAS 1.- Reacción de la superoxido-dismutasa (solo en arerobios): 2O2-. + 2H+ H2O2 + O2 2.- Reacción de la catalasa (peroxidasas): 2H2O2 O2 + 2H2O H2O2 + DH2 D + 2H2O 3.- Reacción de la glutation-peroxidasa. Es el principal sistema de protección endógeno. Tiene 3 funciones: a) ROOH + 2GSH b) H2O2 + 2GSH c) Proteína-S-S-R + 2GSH GSSG + ROH + H2O GSSG + 2H2O Proteína-SH + GSSG + HS-R El GSSG formado se reduce por acción del NADPH mediante una reacción catalizada por la glutation-reductasa: GSSG + NADPH + H+ 2GSH + NADP+ Localización de las enzimas protectoras. Las tres enzimas mencionadas se localizan en distintos sitios intracelulares y parecen desempeñar funciones complementarias entre sí. La catalasa se encuentra predominantemente en los peroxisomas y mitocondrias La glutationperoxidasa en lisosomas, mitocondrias y citosol, pero no en peroxisomas. La superoxido dismutasa en el citosol, aunque existe una segunda forma que también aparece en las mitocondrias (espacio intermembranal). DEFENSAS NO ENZIMÁTICAS 4.- Antioxidantes. Diversos compuestos naturales tienen la capacidad de reaccionar con los radicales libres sin generar nuevos radicales. Algunos ejemplos son el tocoferol (vitamina E) , ácido ascórbico (Vit. C), selenio y el ß-caroteno (Vit. A). Curso 08/09 Pág. 7 EL GLUTATION COMO AGENTE PROTECTOR Las células de mamíferos han desarrollado un sistema de protección para minimizar el daño resultante de la biotransformación de xenobióticos y productos oxidativos normales del metabolismo celular. Este sistema es dependiente de glutation. El glutation es un tripéptido (glutamil-cisteinil-glicina) con gran facilidad para ceder electrones debido a su grupo sulfhidrilo (-SH). Es un importante antioxidante en fase acuosa y un cofactor esencial de enzimas antioxidantes. Da protección también a la mitocondria contra radicales de oxígeno endógenos. En las células se encuentra a concentraciones elevadas (del orden de mM), principalmente en el hígado (10 mM), lo que contribuye a su gran poder reductor. La disminución de GSH conduce a la muerte celular y ha sido descrita en muchas condiciones degenerativas. Las dos funciones principales son: a) Como basurero nucleofílico de muchos compuestos y sus metabolitos, vía mecanismos químicos y enzimáticos, convirtiendo centros electrofílicos en uniones tioeter. b) Como sustrato en el metabolismo de hidroperóxidos (mediado por GSH peroxidasa) a los correspondientes alcoholes. EL GLUTATION COMO AGENTE PROTECTOR Acidos mercaptúricos Glutamato Cisteína Acetil-CoA Glutamilcistein sintasa Conjugados tioester Glicina Glutation sintasa GSH-transferasas DEM CDNB NADP+ Glutation reductasa Glutation reducido GSH NADPH Glutation oxidado GSSG H2 O2 Glutation oxidasa 2H2O En determinadas situaciones, como por ejemplo el ayuno, se incrementa la toxicidad de algunos xenobióticos al disminuir la disponibilidad de aminoácidos, como metionina, importante para la formación de cisteína (componente del glutation). Las principales funciones de las células relacionadas con el poder reductor del GSH son las siguientes: Curso 08/09 Pág. 8 Síntesis de proteínas y DNA Protección celular/antioxidante Conjugación de xenobióticos en hígado Crecimiento y división celular Poder reductor del GSH Resistencia a UV, Protección lente/córnea Reacciones de reducción metabólica Síntesis de leucotrienos Regulación de enzimas-SH PROCESOS PATOLÓGICOS RELACIONADOS CON LAS ROS La citotoxicidad provocada por los RL, origina una amplia patología, de manera que se han relacionado con RL las siguientes enfermedades y procesos clínicos: Envejecimiento, Alzheimer, aterosclerosis, procesos autoinmunes, cáncer, cataratas, dermatitis de contacto, gota, enfermedades inflamatorias, malaria, esclerosis múltiple, pancreatitis, Parkinson, artritis reumatoide, demencia senil, talasemias y colitis ulcerosa. En vista de todo ello, se hace necesario un mejor conocimiento de estos metabolitos tan reactivos y su papel en el organismo. Solo así se podrán encontrar tratamientos eficaces para curar estas enfermedades. La acumulación de especies de oxígeno reactivas (ROS), es uno de los factores que contribuyen a la senescencia celular, el acortamiento de telómeros, daño al ADN e inestabilidad genómica. Lo anterior ha generado un gran interés en su estudio, en particular para analizar su participación en la carcinogénesis, infertilidad, ateroesclerosis y otras condiciones patológicas, así como en el proceso de envejecimiento. ESPECIES REACTIVAS DEL NITRÓGENO (ERNs) Las principales ERNs son el óxido nítrico (NO.) y el peroxinitrito (ONOO-.) considerado como uno de los más potentes oxidantes biológicos. Las ERNs pueden dañar y matar células por distintos mecanismos: inactivación de los distintos complejos de la cadena respiratoria, daño a proteínas y a lípidos, inhibición de síntesis proteica o de ADN, depleción de GSH o de ATP entre otros. Curso 08/09 Pág. 9 La principal fuente de NO, en células de mamíferos, es la oxidación enzimática de Larginina por una NO sintasa dependiente de calcio. Arginina + ½NADPH + 2O2 NO + citrulina + 2H2O + 1½NADP+ El NO. es una molécula de señal ubicua, que funciona en la regulación de distintos procesos en los sistemas nervioso, cardiovascular e inmune. Está asociado a procesos inflamatorios neurotóxicos y de isquemia/reperfusión. El NO difunde desde su célula de origen a las células vecinas ya que es suficientemente apolar para cruzar las membranas plasmáticas sin un transportador. En la célula diana activa el enzima citosólico guanilil ciclasa, que cataliza la formación del segundo mensajero cGMP. En el corazón el cGMP ocasiona contracciones menos enérgicas al estimular la bombas (o bombas) de iones que expulsan Ca2+ del citosol. El NO es inestable y su acción es breve, segundos después de formarse sufre una oxidación a nitrito o nitrato. Los nitrovasodilatadores producen una relajación continua del músculo cardíaco ya que tardan varias horas en degradarse, produciendo una corriente continua de NO (nitroglicerina para tratamiento de la angina, 1860). Se ha propuesto también que el NO. actuaría induciendo la producción mitocondrial de peroxinitrito. Este produciría a su vez la inhibición del complejo I de la cadena respiratoria (NADH:Ubiquinona reductasa), lo cual tiene un efecto crítico sobre el suplemento de energía en varios tejidos y sobre la producción de EROs. Este daño irreversible de la cadena de transporte mitocondrial sería el responsable, en parte, de la muerte neuronal observada en procesos neurodegenerativos asociados a la enfermedad de Parkinson y al Alzheimer. Curso 08/09 Pág. 10
