ACTIVIDADES TEMA 9
Anuncio
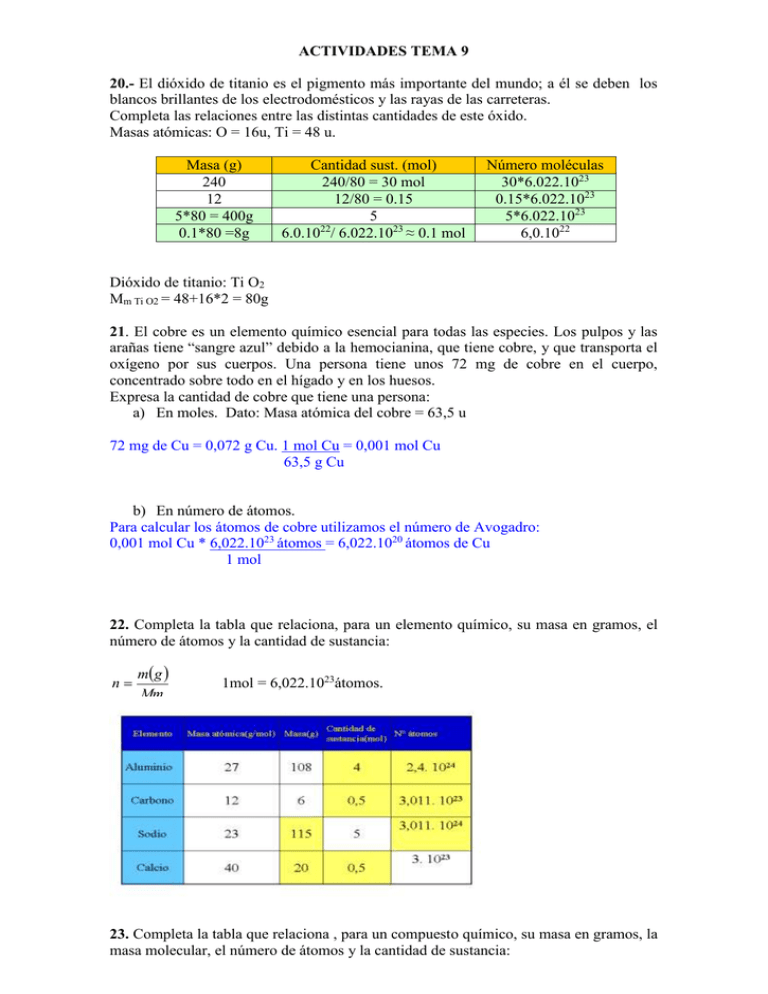
ACTIVIDADES TEMA 9 20.- El dióxido de titanio es el pigmento más importante del mundo; a él se deben los blancos brillantes de los electrodomésticos y las rayas de las carreteras. Completa las relaciones entre las distintas cantidades de este óxido. Masas atómicas: O = 16u, Ti = 48 u. Masa (g) 240 12 5*80 = 400g 0.1*80 =8g Cantidad sust. (mol) 240/80 = 30 mol 12/80 = 0.15 5 22 6.0.10 / 6.022.1023 ≈ 0.1 mol Número moléculas 30*6.022.1023 0.15*6.022.1023 5*6.022.1023 6,0.1022 Dióxido de titanio: Ti O2 Mm Ti O2 = 48+16*2 = 80g 21. El cobre es un elemento químico esencial para todas las especies. Los pulpos y las arañas tiene “sangre azul” debido a la hemocianina, que tiene cobre, y que transporta el oxígeno por sus cuerpos. Una persona tiene unos 72 mg de cobre en el cuerpo, concentrado sobre todo en el hígado y en los huesos. Expresa la cantidad de cobre que tiene una persona: a) En moles. Dato: Masa atómica del cobre = 63,5 u 72 mg de Cu = 0,072 g Cu. 1 mol Cu = 0,001 mol Cu 63,5 g Cu b) En número de átomos. Para calcular los átomos de cobre utilizamos el número de Avogadro: 0,001 mol Cu * 6,022.1023 átomos = 6,022.1020 átomos de Cu 1 mol 22. Completa la tabla que relaciona, para un elemento químico, su masa en gramos, el número de átomos y la cantidad de sustancia: n m g Mm 1mol = 6,022.1023átomos. 23. Completa la tabla que relaciona , para un compuesto químico, su masa en gramos, la masa molecular, el número de átomos y la cantidad de sustancia: Masas atómicas: H = 1u, O = 16u, Na = 23u, C =12u. actividad 6 Queremos preparar 250ml de una disolución acuosa de cloruro de calcio 1,5 M. Calcula qué cantidad de soluto necesitamos. Datos: Vdisolución = 250 ml = 0,25 L M = 1,5 mol/L nsoluto , y conocemos la molaridad y el volumen de la vdisolució n disolución, lo primero que tenemos que hacer es calcular los moles de soluto ( n ), despejando de la fórmula. n = M. Vdisolución n = 1,5 mol/L. 0,25 L = 0,375 mol de CaCl2 Como sabemos que M = actividad 8 Calcula el volumen de disolución de ácido clorhídrico 1,25 M que tenemos que tomar para tener 0,5 mol de ácido Datos: Molaridad = 1,25M (mol/L) n = 0,5 mol. Igual que antes, despejo de la fórmula para calcular el volumen nsoluto n M= Ahora sólo tengo que sustituir los datos que conozco: V vdisolució n M V =0,5 /1,25 = 0,4 L de HCl actividad 24 Te mandan preparar una disolución al 20% en masa de cloruro de sodio y tú crees que significa: 20 g de sal en 100 g de disolvente. Si lo haces así, ¿cuál será la concentración centesimal de la disolución obtenida? Datos: 20 g de soluto (sal) + 100 g de disolvente (agua) 120 g de disolución Sabemos que la concentración en % en masa tiene la siguiente fórmula: % masa = (m soluto/ m disolución ) * 100 Por tanto, sólo tenemos que sustituir los datos que tenemos en la fórmula % masa = (20 /120)*100 16,67% actividad 26 Las bolsas de suero fisiológico de los hospitales contienen una disolución al 9%0 de cloruro de sodio, la misma concentración que las células, ¿Qué cantidades utilizarías para preparar esta disolución? a) 9 g de NaCl en 100 g de agua. b) 9 g de NaCl en 1 L de agua. c) 9 g de NaCl en 9 L de agua. d) 9 g de NaCl en 991 g de agua. Una concentración del 9 por mil implica 9 gramos de cloruro de sodio en 1000 g de disolución, por tanto en 1000 – 9 de agua. Es decir, 9 gramos de soluto y 991 g de disolvente. Entonces la opción correcta es la d) actividad 28 El grado alcohólico de las bebidas se expresa en grados o en tanto por ciento en volumen. Según la normativa vigente, una cerveza “ sin alcohol” puede contener hasta 1% en volumen, que equivale a un grado. Completa la tabla relativa a porcentaje en volumen de distintas bebidas alcohólicas. Para realizar los cálculos tenemos que tener en cuenta que Vdisolución = Vsoluto + Vdisolvente Y que % volumen = Vsoluto . 100 Vdidolución