Determinación crioscópica de la masa molecular
Anuncio

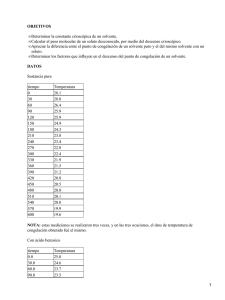
UNIVERSIDAD DE PANAMÁ FACULTAD DE MEDICINA INFORME Nº 7 DETERMINACIÓN CRIOSCÓPICA DE LA MASA MOLECULAR VIERNES, 24 DE SEPTIEMBRE DE 2004. OBJETIVOS • Determinar el descenso del punto de congelación por un soluto. • Calcular la constante crioscópica de un disolvente. • Determinar la masa molecular de un soluto. • Determinar los factores que influyen en el descenso del punto de congelación de un solvente. INTRODUCCION Punto de congelación verdadero. Temperatura a la cual las formas líquidas y sólidas de una sustancia, pueden existir en equilibrio a una determinada presión (usualmente una atmósfera estándar). Punto de congelación. Temperatura a la que el líquido se solidifica, bajo cualquier condición dada. Puede o no ser lo mismo que el punto de fusión o el verdadero punto de congelamiento definido más estrictamente. La disminución del punto de congelación de una solución ( Tc ), con respecto al punto de congelación del solvente puro, al disolver en él un soluto no salino, está dada por: Tc=mKc Donde: m es la Molalidad y Tc es la constante crioscópica del solvente. También se le denomina constante molal del punto de congelación. Para solutos electrólitos y disociables la ecuación para el descenso crioscópico se escribe así: DT = i Kf.m. La i expresa el número de moléculas del compuesto, es decir en el caso del CaCl2, el número de moléculas es tres, entonces la i será tres. La explicación de esto es que un mol de electrolito se disocia en el solvente. A consecuencia de esta disociación, en la solución no habrá una mol de partículas sino dos o tres, o el número de moléculas del 1 compuesto, lo que no ocurre con los no electrólitos como por ejemplo la sacarosa que al disolverse en agua produce un mol de partículas y por lo tanto, una solución que se identifique como 1M, tendrá un punto de congelación de 1.86 °C más bajo que el agua pura, mientras que una solución marcada NaCl 1M tendrá un punto de congelación de 2*1.86 = 3.72 °C más bajo que el agua pura. RESULTADOS • Temperatura de Fusión del Solvente Puro. Tiempo (segundos) 0 30 60 90 120 150 180 210 240 270 300 330 360 390 420 450 480 510 540 570 Temperatura (º C) 30,0 24,0 15,0 13,0 10,0 9,0 8,0 8,0 8,0 7,0 7,0 6,5 (solidifica) 7,0 7,0 7,0 6,5 6,5 6,5 6,5 6,5 • Temperatura de Fusión de la Solución. Tiempo (segundos) 0 30 60 90 120 150 180 210 240 270 300 Temperatura (º C) 8,0 6,0 4,0 2,5 2,0 1,5 1,0 1,0 1,0 1,0 1,0 2 330 360 390 420 450 480 510 540 570 600 1080 1,0 1,0 1,0 1,0 1,0 0,5 0,5 0,5 0 0 −1 (solidifica) • Temperatura de Fusión de la Solución con el Desconocido. Tiempo (segundos) 0 30 60 90 120 150 180 210 240 270 300 330 360 390 Temperatura (º C) 30,0 18,0 9,0 5,0 4,0 3,0 3,0 3,0 2,0 1,0 0 0 0 0 (solidifica) CÁLCULOS • Cálculo de la Constante de Crioscópica Molal. • Densidad del ciclohexano: 0,779 g/ cm3 • Densidad del Benceno: 0,88 g • Kg de solvente: 15 cm3 ciclohexano x 0,779 g/ cm3 = 0,012 Kg. • Molalidad de la solución: 0,5 cm3 x 0,88 g x 1mol = 0,0056 mol. cm3 78 g m= 0,47 3 • Constante: Tc = m Kc (6,5− −1) = 0,47 Kc 15,96 = Kc • Porcentaje de Error: 15,96 − 20,2 = 20,97% 20,2 • Cálculo del Calor de Fusión. Hf = − RT02 M1 m2 Tf Hf = − (8,314)(279,5)2 (84) (0,47/ 1000) = − 3418,92J/mol 7,5 • Masa Molar del Desconocido. Tc = mol soluto Kc Kg solvente (6,5−0) = mol soluto (15,96) 0,0080 0,0032= mol soluto. MM desconocido= 0,5036 g =157,38g/mol. 0,0032 mol CONCLUSION • El punto de fusión y el de congelación para una sustancia pura a una determinada presión, están a la misma temperatura. • El punto de congelación de una sustancia pura desciende cuando a la sustancia se le adiciona un soluto. • El descenso en el punto de congelación es una consecuencia directa de la disminución de la presión de vapor por parte del solvente al agregarle un soluto. • El proceso de congelación, al igual que el de fusión y el de evaporación son procesos isotérmicos. Esto debido a que el calor ganado o perdido por la sustancia es liberado en su transformación de un estado a otro. • El cambio en la presión trae como consecuencia un cambio en el punto de ebullición, congelación y fusión. 4 • Si la constante de fusión es grande la Tf es proporcional a ella, esto quiere decir que será grande también. Por eso usamos el ciclohexano como solvente en esta experiencia, para poder tener un margen amplio en el cambio de temperatura y minimizar el porcentaje de error por la estimación. • El porcentaje de error obtenido en el cálculo de la Kf pudo ser producido por la inexactitud en el termómetro usado. BIBLIOGRAFIA • CASTELLAN, Gilbert W. Fisicoquímica. ADDISON−WESLEY. U.S.A, 1987. Pgs 303−305. • IRAN N. Levine, Fisicoquímica, Ed., Mc. Graw−Hill, Latinoamericana S.A., pág. 337−342. • Guía de Laboratorio de Química Física. FCET Universidad de Panamá. Ágnes de Fotti y demás autores. Año 2002. 5