4.-alquenos - Universidad de Chile
Anuncio
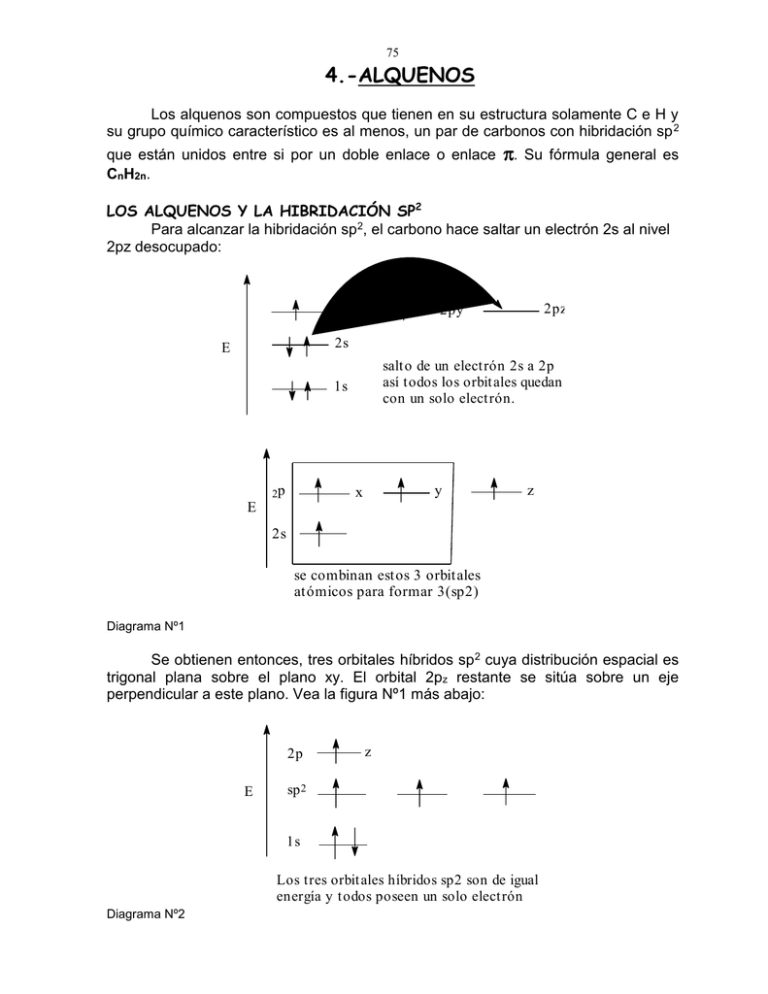
75 4.-ALQUENOS Los alquenos son compuestos que tienen en su estructura solamente C e H y su grupo químico característico es al menos, un par de carbonos con hibridación sp 2 que están unidos entre si por un doble enlace o enlace CnH2n. . Su fórmula general es LOS ALQUENOS Y LA HIBRIDACIÓN SP2 Para alcanzar la hibridación sp2, el carbono hace saltar un electrón 2s al nivel 2pz desocupado: 2px 2pz 2py 2s E salt o de un elect rón 2s a 2p así todos los orbit ales quedan con un solo electrón. 1s 2p y x z E 2s se combinan estos 3 orbitales atómicos para formar 3(sp2) Diagrama Nº1 Se obtienen entonces, tres orbitales híbridos sp 2 cuya distribución espacial es trigonal plana sobre el plano xy. El orbital 2pz restante se sitúa sobre un eje perpendicular a este plano. Vea la figura Nº1 más abajo: 2p E z sp 2 1s Los tres orbit ales híbridos sp2 son de igual energía y t odos poseen un solo elect rón Diagrama Nº2 76 ESTRUCTURA DE UN CARBONO SP2 eje z 2pz plano xy sp 2 sp 2 sp2 Carbono sp2 trigonal plano, con los orbitales híbridos separados por 120º y un orbital 2pz perpendicular a ese plano. Figura Nº1 Dos átomos de carbono con la hibridación como la que se muestra, pueden formar un enlace (c-c) por combinación de dos orbitales atómicos híbridos sp2 y un enlace (c-c) por combinación de los orbitales atómicos 2p z. Estos dos orbitales 2pz deben estar perfectamente paralelos entre sí para que puedan combinarse efectivamente. Esta situación hace que se defina un plano sobre el cual todos los orbitales sp2 de ambos carbonos queden sobre él. Vea la figura Nº2 orbital Pi orbitales sp2 plano xy orbital sigma c-c Los electrones involucrados están representados por cabezas de flecha. Todos los orbitales híbridos pertenecientes a ambos átomos de carbono son coplanares. Figura Nº2 La combinación de estos dos orbitales híbridos aportados por los carbonos producen como ya se ha visto, dos orbitales moleculares: (c-c) enlazante y antienlazante respectivamente, como se observan en la figura Nº3. 77 orbital molecular . antienlazante (a,b)* sigma E Csp2 a Csp2b orbital molecular enlazant e. sigma(a,b) Diagrama Nº3 El orbital (c-c) por otro lado, se construye por simple combinación de los orbitales atómicos 2pz de ambos carbonos. La máxima combinación se logra cuando esos orbitales están perfectamente paralelos entre sí, y todos los orbitales sp 2 quedan coplanares. Vea la figura Nº2 de más arriba. CARACTERÍSTICAS FÍSICAS DE LOS ENLACES C-C Y C-H EN LOS ALQUENOS. (c=c) Energía= 146 Kcal/mol Largo = 1,34 x 10-8 cm Esta energía es aproximadamente 63 Kcal/mol más fuerte que el enlace C-C simple, cantidad que correspondería a la energía del enlace (c-c). Este enlace también es más corto que el del C-C simple, y su valor es aproximadamente 1,34 x 10-8 cm. (=c-H) Este enlace C-H es uno de los más fuertes de su tipo en los hidrocarburos. El hidrógeno se llama vinílico y su energía es de 108 Kcal/mol. Su longitud es aproximadamente de 1,04 x 10-8 cm. El ángulo C=C-C en un alqueno es de aproximadamente 120º dependiendo del volumen de los grupos unidos a los carbonos del doble enlace. NOMENCLATURA 1a.- REGLAS I.U.P.A.C. PARA LOS ALQUENOS La nomenclatura general IUPAC le da nombre a los alquenos sin importar la distribución espacial de sus átomos, sin embargo, como veremos más tarde, la restricción impuesta al interior de la molécula por la presencia del doble enlace, hace que en algunos casos sea este aspecto algo muy importante de considerar. Más adelante consideraremos en detalle este tópico de la nomenclatura. 78 Como metódica general, esta consiste en ir definiendo y aplicando algunas reglas que se complementan con las que ya hemos visto para los alcanos. Estas son: REGLA Nº1.- Elegir como la cadena principal, la cadena más larga que contenga el mayor número de instauraciones, no importando si no es la cadena más larga. En la figura Nº1, la cadena principal es claramente la cadena de ocho átomos de carbono. Aun cuando la cadena más larga es la de 10 átomos, sin embargo, no cumple con la condición de contener el mayor número de instauraciones. CH CHCH3 CH3CH2CH CHCHCH2CH2CH2CH2CH3 Estructura Nº1 REGLA Nº2.- Numerar esta cadena, partiendo del extremo que esté más próximo a la insaturación. De esta manera los sustituyentes quedan automáticamente determinados con relación a su posición en la cadena principal. 5 6 7 8 9 CH CHCH2CH2CH3 CH3CH 1 2 CHCHCH2 CH2CH2CH2CH3 3 4 sust it uyent e Estructura Nº2 REGLA Nº3.- La posición del doble enlace se señala con el número correspondiente al primer átomo de carbono en el doble enlace. Este se antepone al nombre de la cadena principal, la que proviene a su vez del nombre del alcano de igual número de átomos de carbono, al que se le ha cambiado el sufijo ano del alcano por eno del alqueno. CH3 CH3CH CHCH2CHCH2CH2CH3 8 1 2 3 4 5 67 5 - metil - 2 - oct eno Estructura Nº3 REGLA Nº4.- Si hay más de un doble enlace en la cadena principal, esto se indica en el nombre del alqueno, anteponiendo los números correspondientes a la posición de cada uno de ellos. Además, simultáneamente, al sufijo eno debe anteponerse el numeral di para poner de manifiesto que son dos los doble enlaces, tri para tres, tetra para cuatro, etc. según cuantas insaturaciones del mismo tipo se encuentren en la cadena. 79 CH2CH2CH2CH2CH3 CH3CH2CH CHCH2CHCH CHCH3 9 8 7 6 5 4 3 2 1 4- pentil - 2,6 - nonadieno Estructura Nº4 REGLA Nº5.- Si se trata de un compuesto cíclico insaturado, este se numera, comenzando por uno de los átomos de carbono del doble enlace, y continuando en el sentido del doble enlace, hasta cubrir completamente el anillo. Hay que tener presente el caso en que uno de los carbonos del doble enlace posea un sustituyente. Este carbono deberá ser considerado siempre como el carbono uno, tal como se muestra en alguno de los ejemplos que siguen. CH3 CH3 1 5 1 CH2CH3 2 2 1 - metilciclohexeno 1 - etil - 5 - metilciclopenteno 1 2 H3C 5 3 CH3 3,5 - dimetilciclohexeno Estructura Nº5 Además de lo manifestado, hay que tener siempre presente que la numeración en un ciclo debe tener el sentido tal de dar la menor numeración posible a los sustituyentes. Lo que puede ser ejemplificado con la estructura Nº5, ya que si se numera en el otro sentido al mostrado, el nombre errado quedaría como 4,6dimetilciclohexeno. REGLA Nº6.- Los sustituyentes que presenten insaturación se nombrarán de igual modo que la cadena principal de un alqueno, sin embargo, su numeración será siempre partiendo desde el átomo de carbono que tenga la valencia libre. Es decir aquel carbono que esté unido a la cadena principal de la molécula. Aquí, se supone que la cadena principal elegida para el compuesto contiene un mayor número de instauraciones que las del sustituyente. CH3 CH3CH CHCHCH2 5 4 3 2 1 CH3CH CH 3 2 1 CH2 CHCH2 3 2 1 2 - metil - 3 - pentenil 1 - propenil 2 - propenil Estructura Nº6 REGLA Nº7.- Los sustituyentes con valencia doble terminan en el sufijo ilidén: 80 CH3CH etiliden CH3CH2CH CH3CH2CH2CH butiliden propiliden Estructura Nº7 REGLA Nº8.- Los sustituyentes con valencia doble (ilidén) e insaturados con doble enlace (enil) cambian su terminación a enilidén. La insaturación debe ser indicada con un prefijo numérico en la cadena principal del sustituyente que indicará la posición del doble enlace dentro de él. CH3 CH2 CHCH 2 - propeniliden CH2 CCH2CH 3 - metil - 3 - buteniliden Estructura Nº8 Problemas: Los siguientes compuestos están nombrados adecuadamente según nomenclatura IUPAC. incorrectamente. Nómbrelos 4-ciclohexenil-5-metil-8(1,2,2-trimetiletenil)-10(2-metil-2-propenil)12,12,14,14tetrametilbiciclo[1.5.6]2,8-tetrahexadieno 2-(3-metil-2-butenil)-6-(1,1dimetilmetiol)-11-(1,3ciclopentadienil)espiro[6.5]3,6,10-decaditrieno 1B.- NOMENCLATURA CIP (E Y Z). REGLAS DE CAHN-INGOLD-PRELOG. 81 El doble enlace entre un par de átomos de carbono introduce tal rigidez en la molécula que impide totalmente, a diferencia del enlace simple, la rotación libre entre ellos. Esta restricción tiene consecuencias importantes en la forma en que observamos la distribución espacial de los átomos de la molécula (configuración) y también en las propiedades físicas de ella. Así, por ejemplo: C2H5 C C2H5 CH3 C C H H C H H CH3 (B) (A) Estructura Nº9 Estas dos moléculas (A) y (B) tienen igual fórmula global C 5H10 pero diferente distribución espacial de sus átomos. Estos se denominan isómeros espaciales o configuracionales. Estas diferencias físicas y estructurales deben ser reflejadas en el nombre de los compuestos. Para el ejemplo citado más arriba, es fácil determinar su configuración con los conocimientos que hemos adquirido hasta este momento. Así la molécula (A) es CIS puesto que los dos sustituyentes de los carbonos del doble enlace están al mismo lado y la (B) es TRANS por cuanto ambos sustituyentes están en lados opuestos del doble enlace. Sin embargo la cosa se complica un poco cuando hay tres o cuatro grupos sustituyentes distintos involucrados con el doble enlace. Por ejemplo ¿Cual es la configuración de las moléculas (C) y (D)? C2H5 C CH3 C2H5 C C H C3H7 CH(CH3)2 C CH3 C4H9 (C) (D) Estructura Nº10 O bien en ¿(E) y (F)?. C2H5 C CH3 Br (E) CH(CH3)2 C C H Cl C Br C4H9 (F) Estructura Nº11 Note usted que en las moléculas (E) o (F) hay otros átomos involucrados diferentes al C e H. En este caso, hay halógenos. Para determinar la configuración de un alqueno de esta clase, se deben aplicar sucesivamente un conjunto de reglas conocidas como reglas de Cahn, Ingold 82 y Prelog CIP ó nomenclatura CIP, las que son muy generales y permiten asignar la configuración a moléculas con átomos diferentes unidos al doble enlace. REGLA Nº1.- Esta regla se basa en la comparación de los “números atómicos” de los átomos geminales o átomos de grupos geminales, es decir, aquellos que están unidos directamente a uno de los átomos de carbono del doble enlace. Así, aquel átomo que posea mayor número atómico tendrá preferencia sobre el otro. Finalmente, entonces, al tomar en conjunto ambos átomos de carbono del doble enlace, podrá verse si las preferencias están al mismo lado del doble enlace (Z) o en lados opuestos del doble enlace (E) En el caso de los isótopos, hay que tomar aquel de mayor masa atómica. Según esto, el átomo de mayor prioridad será el yodo y barriendo hacia la menor prioridad llegaremos al último que es el hidrógeno. R1 C C C C Cl C H N H C H R2 O H átomos geminales átomos geminales grupos geminales Figura Nº3 REGLA Nº2.- Cuando la precedencia no puede establecerse por ser idénticos los átomos directamente unidos al carbono del doble enlace, entonces, se busca y compara la primera diferencia que encontremos al desplazarnos a través de los átomos sucesivos de cada grupo. Buenos ejemplos son las moléculas (C) y (D) C2H5 C CH3 C C H C3H7 (C) C2H5 CH(CH3)2 C CH3 C4H9 (D) Estructura Nº12 En la molécula (C), los grupos unidos al carbono derecho del doble enlace son -CH3 y -CH2-CH2-CH3. ¿Cuál tiene mayor precedencia? Al desarrollar sus estructuras y comparar los átomos que están unidos a lo largo de la cadena, podemos encontrar la primera diferencia que nos va a permitir determinar cuál grupo tendrá la precedencia. 83 H C 1 CH3 C C n propilo H CH2CH2CH3 2 metilo H 1 1 H 3 C 1 - 2 H Figura Nº4 Mientras que el carbono del grupo metilo está unido a solamente tres hidrógenos, el grupo propilo tiene el carbono (1) unido a dos átomos de hidrógeno y al carbono (2) Como el carbono tiene mayor número atómico que el hidrógeno, esta diferencia le confiere la precedencia al grupo propilo sobre el metilo. Veamos este otro ejemplo de alqueno: H3C CH3 C C CH2OH H3CH2CH2C Estructura Nº13 Del carbono izquierdo ya sabemos que el grupo propilo tiene la precedencia con respecto al carbono derecho del doble enlace podemos desarrollarlo de la misma manera y examinar su estructura: H C 1 C CH3 H CH2OH H 1 H metilo O hidroximetil 1 C 1 H Figura Nº5 Al buscar la primera diferencia encontramos que esta está en que el número atómico del oxígeno es mayor al del hidrógeno. Por lo tanto la configuración de este alqueno es: Z H3C CH3 C H3CH2CH2C C CH2OH Estructura Nº14 Puesto que ambos grupos principales están al mismo lado del doble enlace. 84 REGLA Nº3.- Los enlaces múltiples entre átomos de un grupo sustituyente se consideran como si cada enlace múltiple uniera de manera simple a ese mismo átomo con el otro tantas veces como enlaces múltiples estén presentes. Por ejemplo: O C O C equivale a H C O H N N C equivale a C N N C C Figura Nº6 Si se aplican correctamente estas tres reglas a los alquenos, no debería haber ambigüedades en la asignación de la configuración. Problema: Resuelva la configuración de la siguiente estructura según las reglas CIP: La configuración de (A) es Z o E?. (A) H3CO COOH H3COC CH2Cl SÍNTESIS DE ALQUENOS. 1.- REACCIONES DE ELIMINACIÓN: Las principales técnicas de obtención de alquenos a escala de laboratorio o menor son entre otras las siguientes: 1.a.- Deshidratación de alcoholes con ácidos. Este método hace uso de un ácido inorgánico fuerte como el ácido sulfúrico concentrado como catalizador. El alcohol es calentado a reflujo en esta mezcla y el alqueno producto es destilado posteriormente. R1 CH2 CH R2 + H2SO4 OH 1 R1 CH2 CH R2 + HSO4 OH2 Oxonio 85 La reacción transcurre en varias etapas, con formación de un carbocatión como intermediario en la etapa lenta. 2 R1 CH2 CH R2 Lenta OH2 R1 CH CH R2 + H2O R1 CH2 CH R2 Carbocatión 3 + HSO4 R1 CH CH R2 + H2SO4 H Esquema Nº1 La velocidad de la reacción dependerá de la estabilidad del carbocatión que se forme. Mientras más estable sea, más rápida será la reacción de deshidratación. La gran desventaja de este método está en la posibilidad de que ocurra reordenamiento del esqueleto carbonado. (Vea más adelante “estabilidad de los alquenos".) 1.a.1- Estabilidad de los carbocationes. Esta propiedad está relacionada con el efecto electrodador de los grupos alquilos. El efecto dador típico de estos grupos contribuye a la dispersión de la carga positiva localizada en el carbono central, dando como consecuencia una mayor estabilidad a la especie intermediaria. Es de esperar entonces que a mayor número de grupos alquilos, mayor será la estabilidad. R1 R2 CC R3 CARBOCAT IÓN Figura Nº7 La estructura del carbocatión proviene de la hibridación del carbono central que es sp2 por tanto es plana con un orbital 2p vacío perpendicular al plano definido por los enlaces sigma. ( Figura Nº7) Esto trae como consecuencia que el ataque de un reactivo nucleofílico pueda acceder a este carbono por arriba o por abajo del plano definido por los sustituyentes del carbocatión. R1 R1 C R2 R1 C R3 > R2 H > H C H ESTABILIDAD Diagrama Nº4 H > C H H 86 1.b.- Deshidrohalogenación de halogenuros de alquilo con bases. Esta reacción se produce ante la presencia de una base fuerte como el hidróxido de potasio en etanol u otras bases como etóxido de sodio en etanol o alcóxido en su respectivo alcohol. El uso de bases pequeñas (KOH/Etanol) produce alquenos más sustituidos, en cambio el uso de bases voluminosas como terbutóxido de sodio en terbutanol produce preferentemente otro alqueno, diferente al más sustituido. (Producto no Saytzeff) H R1 CH CH R2 + B H + X B + R1 CH CH R2 X base halogenuro alqueno halogenuro de alquilo Esquema Nº2 De al menos un argumento que sostenga la siguiente afirmación: El carbocatión (A) es más estable que el carbocatión (B). RCH RCH2CH2CHR' CHCHR' (A) (B) 1.b.1- Estabilidad de alquenos. (Regla de Saytzeff) Algunas reacciones de síntesis de alquenos, pasan por la formación de un intermediario (carbocatión) estabilizado por ser el más sustituido o bien se ha estabilizado por reordenamiento para formar un carbocatión más estable. CH3 CH3 H3C C C CH3 H Carbocatión 2º CH3 CH3 CH3 H3C C C CH3 H REORDENAMIENTO H3C C C CH3 CH3 H Carbocatión 3º Formación de un carbocatión 3º más estable a partir de uno 2º por migración de un metiluro CH3- 87 El paso siguiente es la eliminación de un protón para producir el alqueno. Muchos de estos intermediarios poseen más de un tipo de hidrógeno vecino al carbono portador de la carga positiva que puede ser eliminado generando por tanto más de un alqueno. Algunas veces se producen mezclas de alquenos sin embargo en otras solo se produce uno de los isómeros. La formación del alqueno más sustituido es clave en este tipo de eliminaciones. Se sabe que cada grupo alquilo estabiliza al alqueno en cuestión en aproximadamente 1 - 3 Kcal/mol a través del mecanismo llamado hiperconjugación y así la regla de Saytzeff dice que en estas circunstancias el producto predominante será el más sustituido. Sin embargo, debe tenerse presente que el alqueno más sustituido será una mezcla de estereoisómeros E y Z, siendo el más favorecido entre ellos aquel que tenga los grupos más voluminosos en lados opuesto al doble enlace. R1 C R2 R1 R2 C R3 R1 R4 R2 (A) C C H R1 H H C C R3 H R1 H R2 R1 H H (E) (D) H H C C (G) C C (F) H H Estructuras de alquenos sustituidos Estructura Nº15 (A) > (B) > (C) > (D) > (E) > (F) > (G) ESTABILIDAD Mayor Menor Diagrama Nº5 H (C) (B) C C C C R2 H H 88 Ejemplo de estabilidad: CH3 CH3 CH3CH2 H C C H H3C H3C C C H3C CH H H C C H H CH3 d H= -30,3 d H= -28,5 d H= -26,9 CH3 CH3CHCH2CH2 Calor de hidrogenación de tres alquenos isómeros para llegar al 2-metilbutano.Est a comparación permite observar que a mayor sustitución del alqueno mayor estabilidad. Diagrama Nº6 El proceso de hidrogenación es exotérmico y aquí, H < 0 es el calor de hidrogenación. Se ve claramente que el alqueno monosustituido es el que entrega mayor cantidad de energía para llegar a ser el 2–metilbutano que es el producto estable común para los tres alquenos isómeros. En cambio para el alqueno trisustituido, la cantidad de energía devuelta es bastante menor poniendo de manifiesto que es mucho más estable. Puede verse claramente el efecto de la sustitución sobre la estabilidad de los alquenos, mientras más sustituido sea, más estable es y menor la energía que entrega. 2.- Hidrogenación de alquinos: El uso de diferentes catalizadores en la hidrogenación de alquinos, permite conducirla para obtener diferentes productos. Así, el catalizador de Lindlar es utilizado para hidrogenar un alquino selectivamente a alqueno Cis. El catalizador está constituido por paladio metálico depositado en un soporte o portador inorgánico como carbonato de sodio. La transferencia del hidrógeno desde la superficie del metal al alquino se lleva a cabo siempre desde un mismo lado de la molécula, de ahí que resulte un alqueno Cis. Para hidrogenar un alquino a alqueno Trans selectivamente, debe usarse Litio metálico en amoníaco como solvente. En esta reacción hay transferencia de 89 electrones entre el alquino y el Litio y de protones entre el solvente y el alquino. Esta adición se lleva a cabo en dos etapas. Vea el mecanismo en el capítulo de alquinos. alqueno CIS Lindlar ALQUINO Li, NH3 alqueno TRANS Esquema Nº3 3.- Reacción de Wittig.Este método de síntesis de gran versatilidad, fue descubierto por el químico alemán Georg Wittig en el año 1954. En el año 1997 obtiene el premio Nóbel de Química en homenaje a su brillante descubrimiento. Note Ud. que puede obtener alquenos de diferentes estructuras. Su mecanismo está desarrollado más abajo: En esta reacción, un halogenuro de alquilo (Los halogenuros de arilo, no pueden utilizarse porque el mecanismo de la reacción exige poco impedimento estérico) es atacado por un reactivo nucleofílico (vea capítulo I) Esta reacción transcurre en condiciones suaves y la posición del doble enlace en el producto está perfectamente determinado. (Regioselectividad). El papel del nucleófilo está representado por la trifenilfosfina ( Ph 3P: ) y el sustrato es un halogenuro de alquilo primario o secundario. El solvente puede ser DMSO (dimetilsulfóxido) o THF (Tetrahidrofurano) que son ejemplos de los muchos solventes apróticos (sin gropos O-H o N-H) que pueden formar enlaces hidrógeno. (Vea el capítulo derivados halogenados). (Ph)3P + CH2 Br trifenil fosfina R (Ph)3P CH2 R + Br Los hidrógenos del CH2 vecino al fósforo, son relativamente ácidos (pKa = 35), y pueden ser eliminados con bases de pK a mayor como por ejemplo: n-butillitio, Sal sódica del dimetilsulfóxido, etc. H (Ph)3P CH R + BuH + Li BuLi iluro butil litio La especie formada en esta primera etapa que es una especie polarizada se estabiliza formando un doble enlace C=P que se llama iluro o fosforano. (Ph)3P CH R + (Ph)3P CH R (Ph)3P CH R iluro La etapa siguiente, es aquella en que reacciona este iluro rápidamente con el compuesto carbonílico (aldehído o cetona) formando una betaina intermediaria. Hay que hacer notar en este momento que tanto el iluro como el compuesto carbonílico pueden tener una amplia gama de sustituyentes, lo que hace que esta reacción sea tremendamente importante. 90 (Ph)3P CH R O C (Ph)3P CH R O C R1 R2 betaina R1 R2 (Ph)3P CH R O C R1 R2 (Ph)3P CH R O C R1 R2 Posteriormente, y esto no está claro, se separa en: (Ph)3P CH R O C R1 R2 H (Ph)3P O óxido + C R C R1 R2 alqueno Esquema Nº4 La betaina es muy reactiva y se reordena en el alqueno producto principal y óxido de trifenilfosfina como producto secundario o lateral. Donde los Ri son radicales alquilos con cualquier estructura. En esta reacción, es perfectamente posible determinar la posición del doble enlace aunque no es una reacción estereoespecífica porque no especifica cuál es el isómero principal. Aquí se produce generalmente una mezcla de isómeros cis y trans, ya que cuando el compuesto carbonílico se acerca al compuesto fosforado lo puede hacer de frente o de espalda. REACCIONES DE ALQUENOS 1.- REACCIONES DE ADICIÓN: 1a.- Adición Markovnikov de H - X (X = Cl, Br) y la (Regioquímica) Esta reacción comienza con el ataque del protón sobre el enlace de un alqueno (aquí se utiliza un alqueno asimétrico para darle al ejemplo una validez más general), y esta adición del protón al doble enlace tiene la posibilidad de formar dos carbocationes intermediarios. Uno primario y uno secundario. La reacción ocurre naturalmente a través del intermediario más estable, ya que es el de menor energía y por tanto el que se formará más rápido. Luego el halogenuro se une a este carbocatión, dando como producto un solo halogenuro de alquilo y no una mezcla. La adición se produce siempre de la misma manera, es decir, tiene una orientación específica o regioquímica. Este hecho fue descubierto por el químico ruso de apellido Markovnikov y se la conoce como regla de Markovnikov. 91 R1 C C H H H H R1 X + H C H H H C C H H carbocatión 2º (más estable) H carbocatión 1º H R1 X H R1 C X + H R1 H H + H H C H H Esquema Nº5 1b.- Adición de X2 (X = Br) El mecanismo de adición de halógeno al doble enlace muestra que ambos átomos de halógeno entran por lados opuestos. R1 C C H H H + X X R1 H C C H + H X X La formación de un intermediario cíclico en esta etapa, previene la posibilidad de que un segundo átomo de halógeno entre por el mismo lado. Esta forma de adicionarse es conocida como adición Anti, en oposición a la adición Syn que es la adición por el mismo lado del doble enlace. R1 H C C X H H R1 + X X C H H C X H Esquema Nº6 Otro ejemplo de que la adición de halógeno a un doble enlace es anti puede verse más abajo donde queda demostrada la estereoquímica de la reacción. En una segunda etapa el bromuro ataca nucleofílicamente al carbono más sustituido puesto que es el que mejor acomoda la deficiencia electrónica provocada por el ataque del bromo polarizado. 92 Br H CH3 H CH3 Br Br Br Br H Br Ejemplo de la adición anti de bromo al met iciclohexeno CH3 Esquema Nº7 1c.- Adición de X2 (X= Br) en presencia de agua. (Formación de bromhidrinas) Esta reacción presenta regioquímica (Markovnikov) y la adición de los reactivos es Anti. R1 H C C H H X + X R1 C C H H H + X X A semejanza de la adición de halógeno al doble enlace en tetracloruro de carbono. R1 C H C H H OH2 R1 + H2O C H X C X H H Nótese que aquí hay dos nucleófilos en competencia. Por un lado está el halógenuro (Bromuro) y por el otro lado está el agua. Aquí el nucleófilo ganador es el agua porque es el solvente y por tanto, su concentración en la reacción es abrumadoramente mayor que la de bromuro. R1 OH2 C H C X OH R1 H H H C + X H C X + HX H Esquema Nº8 1d.- Adición anti-Markovnikov de H - Br en presencia de peróxido (RO-OR) Esta reacción es regioquímica pero inversa a la mostrada por Markovnikov. Se orienta de esta manera debido a la estabilidad de los radicales libres. El orden de estabilidad de estos intermediarios es semejante a la que presentan los carbocationes: 1º < 2º < 3º. 93 En la etapa de inicio se genera un radical alcóxido que rápidamente reacciona con la molécula de ácido bromhídrico para formar una molécula del alcohol y un radical bromuro. 2 RO RO OR RO ROH + Br + HBr Esquema Nº9 El bromuro tiene dos alternativas al reaccionar con el alqueno. Estas están representadas por las vías (a) y (b) en el esquema Nº 10. Br (a) via (a) R1 CH CH2 + Br (b) via (b) R1 CH CH2 radical 1º ( inestable) Br R1 CH CH2 radical 2º (estable) Esquema Nº10 Sin lugar a dudas, la estabilidad del radical secundario es mayor y por lo tanto la reacción marchará por esta vía. La posibilidad de formación de ambos radicales es real, pero la espacie más estable se formará más rápidamente y el paso final dará lugar a la formación de una gran cantidad del producto que se describe en el paso siguiente. La otra vía, desembocará en un producto que en este caso no pasará a ser más que una impureza en el producto final de reacción. Br R1 CH CH2 H + H Br Br R1 CH CH2 + radical 2º Reacción de adición AntiMarkovnikov Esquema Nº11 2.- REACCIONES DE HIDRATACIÓN: 2a.- Hidratación con ácidos fuertes. (H2SO4) Br 94 Como esta reacción, pasa por un intermediario carbocatión, es posible ver a menudo reordenamientos del esqueleto carbonado y por lo tanto, llegar a un producto distinto al esperado. Este es un problema que se presenta potencialmente en todas las reacciones con carbocationes. R1 CH CH R2 + H2SO4 R1 CH CH R2 + HSO4 H El ataque del protón será sobre aquel carbono que pueda producir el carbocatión más estable posible en esta etapa. R1 CH2 CH R2 R1 CH2 CH R2 + H2O OH2 Posteriormente se produce el ataque nucleofílico de agua: R1 R1 CH2 CH R2 + HSO4 OH2 CH2 CH R2 + H2SO4 OH Esquema Nº12 Finalmente el protón es extraído por la base conjugada del ácido, en este caso, la base bisulfato. 2b.- Hidratación por Oximercuración-reducción (Hg(OAc)2, H2O y NaBH4) Esta reacción presenta regioquímica, porque el grupo OH (hidroxilo) se une siempre al carbono más sustituido en el alqueno original y produce entonces un solo alcohol. RCH CH2 Hg(OAc)2,H2O,THF NaBH4 RCH(OH)CH3 RCH CH2 + Hg(O Este intermediario ac sustituido y por lo tan en ese lugar, dando 95 R OH2 H C C + H2O H OH2 R H C C H HgOAc OH H C C R H H HgOAc H OAc NaBH4 H HgOAc H C C R H H H Esquema Nº13 2c.- Hidratación por Hidroboración-oxidación (BH3 y H2O2 en medio alcalino) Adición Syn. Como la adición del reactivo se produce por el mismo lado, se dice que presenta adición Sin. Además el grupo OH se une siempre al carbono menos sustituido, por lo tanto es también selectiva (regioquímica) e inversa a Markovnikov. En resumen es Anti-Markovnikov. 3 RCH CH2 + H2O2, NaOH 3 H3BO3 BH3 3 RCH2CH2OH Esquema Nº14 El mecanismo de esta reacción es el siguiente: R RCH CH2 + - H H + BH2 H C C H B H2 H Este paso se repite con cada hidruro del borohidruro hasta llegar a: R H H R C C H B(CH2CH2R)2 H H H C C H B(CH2CH2R)2 H En la que los tres hidruros del hidruro de boro han reaccionado con tres moléculas de alqueno. Es decir un mol de hidruro de boro es capaz de reaccionar con tres moles de alqueno. 96 R H R H H2O 2, NaOH 3 H3BO 3 C C H B(CH2CH2R)2 H H C H C H H OH 3 Esquema Nº15 Un análisis detallado de lo que sucede en la última etapa, es decir, la oxidación con agua oxigenada en un medio alcalino se muestra más abajo: La reacción entre el peróxido de hidrógeno (agua oxigenada) y el hidróxido de sodio que representa el medio alcalino, es una simple reacción ácido-base, donde el peróxido actua como ácido. H O O H H O + NaOH O Na + H2O Este nucleófilo ataca rápidamente al átomo de boro del trialquilborano, enlazándose fuertemente a él. OH O (RCH2CH2)2B H C O OH H H C H H (RCH2CH2)2B H C H R H C R El compuesto formado rápidamente se reordena para quedar el átomo de boro ahora unido al oxígeno y este a su vez al carbono. Es un reordenamiento que no involucra al radical alquilo y por lo tanto los átomos que lo rodean conservan sus posiciones relativas. OH OH O (RCH2CH2)2B H C H HO (RCH2CH2)2B H H Esquema Nº16 (RCH2CH2)2B H H H C O H C C H R H R H O H C C OH H H R H C H H C R + (RCH2CH2)2B OH 97 El último paso se repite dos veces más, cada vez sobre cada uno de los grupos alquilo del trialquilborano. Entonces el tratamiento final con peróxido de hidrógeno en medio alcalino en el mismo recipiente, lleva a la formación de tres moles del alcohol. La utilidad de esta reacción reside en que es antimarkovnikov y syn permitiendo obtener por ejemplo alcoholes con el grupo funcional en el extremo de la cadena. 3.- REACCIONES DE OXIDACIÓN: 3a.- Oxidación con O3 (Zn / H2O) :(Ozonolisis reductiva) Los productos principales en esta reacción son aldehidos y cetonas. Nótese que todos los dobles enlaces se destruyen (simultáneamente) oxidándose y generando en presencia del Zn metálico, un grupo carbonilo en cada carbón sp2. La reacción de oxidación no procede más allá. El ozono forma rápidamente frente al alqueno una especie química inestable llamada molozónido, el que se reordena a una especie más estable u ozónido. R1 C C R3 R1 + O3 R2 H R2 R1 R3 C R3 O O O O R1 C C C C H R3 C H H R2 O O O O O molozónido ozónido Este ozónido reacciona con el agua hidrolizándose para dar los productos: R2 O R1 C R2 C O O + H R3 R1 R3 + H2O2 C O + O C H2O R2 cetona H aldehido EsquemaNº17 Como puede verse, la hidrólisis del ozónido por el agua produce aldehídos y cetonas según el caso, pero como subproducto de la reacción se forma también el agente oxidante peróxido de hidrógeno. Si este agente oxidante no es eliminado, la reacción de oxidación del doble enlace continua oxidando ahora al aldehído hasta llegar a ácido carboxílico. Para evitar que suceda esta última reacción de oxidación, se agrega Zn metálico. Este metal evita que el H2O2 junto con el exceso de ozono en el medio, continúen con la oxidación. H2O 2 + Entonces: Zn Zn(OH)2 98 O R1 C C R2 + Zn / H2O H O O R3 R1 R3 + Zn(OH)2 C O + O C H R2 cetona aldehido Esquema Nº18 3b.- Oxidación con KMnO4, en medio ácido neutro y diluido. El permanganato de potasio en medio ácido es un fuerte agente oxidante, por lo que el proceso de oxidación del alqueno no se detiene con la formación de aldehído sino que sigue hasta dar ácidos carboxílicos. Generalmente se prefiere usarlo en disoluciones neutras. Ejemplos: R1 R2 C KMnO4, H C o neutro H H R1 C R3 KMnO4, H C o neutro H R2 + R1COOH R2COOH R1 C O R3COOH + R2 Esquema Nº19 Cuando el alqueno es terminal, además del ácido carboxílico si es monosustituido o cetona si es di sustituido geminal, se produce dióxido de carbono. H R1 C H H R1 o neutro R1COOH KMnO4, H C o neutro H + CO 2 + CO2 R1 H C R2 KMnO 4, H C C O R2 Esquema Nº20 En todos los casos el permanganato con manganeso en estado de oxidación (+7) al actuar como oxidante se reduce al estado de oxidación (+4) lo que se pone de manifiesto en la aparición de un precipitado pardo de dióxido de manganeso MnO2, el cual es fácilmente separable del medio por simple filtración. 99 4.- REACCIONES DE HIDROXILACIÓN: 4a.- Hidroxilación con OsO4, (Na HSO3) Adición Syn. Con el OsO4, el alqueno forma un aducto sólido de color negro que puede ser aislado por filtración. CH3 O CH3 OsO4 piridina H CH3 O O Os O H O Os O H O CH3 OH NaHSO 3 H2O OH O H Esquema Nº21 4b.- Hidroxilación con KMnO4, en medio alcalino. Adición Syn. En esta reacción en frío, se forma el glicol. H2O OH + KMnO4 O O HO OH Mn O O Esquema Nº22 5.-REACCIÓN DE EPOXIDACIÓN Los heterociclos de tres átomos entre los cuales están los epóxidos, fueron conocidos años atrás como óxidos de alqueno. Entre ellos están los: CH3 O O Oxido de etileno Óxido de propileno ambos son nombres comunes. IUPAC usa el prefijo epoxi para estos compuestos químicos y luego la terminación alcano. Por ejemplo: 1 2 3 CH3 CH 4 5 CH CH2CH3 H3C O O 2,3-epoxipentano 4-meti-1,2-epoxiciclohexano 100 La química de los epóxidos está entre las propiedades fundamentales de los alquenos. 5.1.-Síntesis de epóxidos: Estos compuestos son fácilmente preparados con la reacción de epoxidación. Consiste en hacer reaccionar un peroxiácido, entre los cuales está el peroxiacético como el reactivo más común en este tipo de reacciones. O O H CH3 C O ácido peroxiacético y un alqueno por supuesto. El peroxiacético enfrenta al doble enlace π de manera tal que rápidamente hay transferencia y reordenamientos electrónicos: R1 H C C R1 H H O O O C C CH3 R2 H O C R2 H e póxido H O + O C CH3 Esquema Nº23 El solvente de esta reacción puede ser ácido acético. Nótese que es una adición syn al doble enlace sin alterar el contorno de los átomos restantes a los carbonos sp2, es decir si el alqueno es cis (Z) o trans (E) se mantiene la configuración o distribución espacial de los átomos del alqueno. 5.2.-Apertura del anillo epóxido. El complemento lógico de la formación de los éteres cíclicos es la reacción de apertura. Es interesante examinar esta reacción puesto que permite alcanzar a partir de un alqueno su hidroxilación trans. (Recuerde la hidroxilación cis obtenida desde un alqueno por tratamiento con KmnO4/OH- o OsO4/NaHSO3). La apertura del éter cíclico puede llevarse a cabo tanto en medio ácido como en medio básico, pero su principal agente impulsor es la fuerte tensión angular del pequeño anillo etéreo. 5.2.a) en medio ácido: Esta reacción es catalizada por un ácido HB, y su protón ataca al oxígeno del anillo. 101 R1 H R1 H C C O + C H B + B OH C R2 R R2 R el ataque del nucleófilo H2O se lleva a cabo sobre el carbono más sustituido del anillo, ya que es el que mejor acomoda la carga positiva. (Recuerde la estabilidad de los carbocationes): R1 H C R2 H2O OH C R R R2 C R1 C + H2O H OH el protón del intermediario es retirado por la base conjugada del ácido catalizador de la reacción: R2 OH OH2 C R R1 C + R2 B H R OH C C R1 + BH H OH diol tran s Esquema Nº24 El resultado final del proceso es la hidroxilación trans del doble enlace original. 5.2.b) en medio alcalino: Sea el grupo alquilo R1 un etilo, propilo, isopropilo, etc. Y R2 un hidrógeno o un metilo, por ejemplo. R2 H C C O OH R1 H + HO R2 H C C R1 H O En este caso el ataque nucleofílico de la base es sobre el carbono menos impedido estéricamente. 102 OH OH R2 H C C R1 + H OH H R2 C C H R1 + OH H OH O diol tran s Esquema Nº25 Los mecanismos de ambas aperturas ya sea en medio ácido o en medio básico, obedecen a circunstancias físicas diferentes 6.- REACCIÓN DE HALOGENACIÓN ALÍLICA. sustitución versus la adición por radicales libres) (El problema de la Al tratar el tema de la halogenación de alcanos en el capítulo tres, se vio que es una reacción de sustitución donde participan radicales libres. Así por ejemplo, en la etapa de inicio y propagación se tiene respectivamente que: Etapa de inicio: X2 Luz UV 2X Calor Etapa de propagación: CH4 + X CH3 + HX CH3 + X2 XCH3 + X Las condiciones necesarias para que se produzca esta reacción es alta temperatura o radiación UV. Esto facilita la generación, en la etapa de inicio, del radical halógeno X.. Por otro lado, en el capítulo cuatro, se vio también, que hay otra reacción donde intervienen radicales libres, que es aquella de adición de HX a un doble enlace. Esta reacción requiere de la presencia de un peróxido, para generar en la etapa de inicio, el radical X. el que se adiciona posteriormente al doble enlace del alqueno, en la primera fase de la etapa de propagación: Etapa de inicio: calor 2RO RO OR RO + HX ROH + X Etapa de propagación: X + CH2 HX + CH2 CH2 CH2 CH2X CH2X CH3 CH2X + X Ambas reacciones tienen en común al intermediario X., el que puede ser generado de igual manera, como por ejemplo por calor o luz UV. La cuestión que inmediatamente se hace presente, a la luz de estos antecedentes es: Si ambos procesos de halogenación suceden a través de un 103 intermediario común y que además, es generado de igual manera, ¿será posible entonces, dirigir la halogenación hacia la adición de halógeno al doble enlace o hacia la sustitución, si partimos de un sustrato que muestre la posibilidad de ambas reacciones? Por ejemplo, un simple alqueno. R CH2 CH CH2 La respuesta a esta interrogante según H. G. Brown, Profesor de Química de la Universidad de Pardue, es si, siempre que se elijan cuidadosamente las condiciones experimentales. El dice, por ejemplo que: La reacción de adición al doble enlace se produce siempre que exista una concentración significativa del halógeno en el seno de la reacción. Esto se debe a que según él, la primera fase de la etapa de propagación es un equilibrio entre el alqueno junto al radical halógeno por un lado y por otro lado el nuevo radical intermediario como se muestra en el esquema siguiente: R R CH2 CH2 CH CH X R CH2 CH CH2X + X2 R CH2 CHX CH2 + CH2X CH2X + X En consecuencia, si el intermediario (lado derecho del equilibrio) no encuentra rápidamente una molécula de halógeno, se devolverá hacia los reactivos (lado izquierdo del equilibrio) dando lugar a la reacción de sustitución. R R CH2 CH CH CH X R CH + X2 R CHX CH CH2 + CH2 CH CH2 + HX CH2 + X Como es una reacción promovida por radicales libres, debe usarse, por supuesto, un solvente apolar que ayude a generarlos como es el tetracloruro de carbono. El halógeno puede ser cloro o bromo, aunque generalmente se utiliza el bromo, además su concentración será dependiendo del tipo de reacción que queramos llevar a cabo. Así si queremos adicionar el halógeno al doble enlace, debemos usar una concentración significativa de él en el medio reaccionante. En caso contrario, si queremos priorizar la reacción de sustitución, debemos procurar que la concentración del halógeno sea lo más baja posible en el ceno de la reacción. Como veremos más tarde, esto se logra con la ayuda de un reactivo especial llamado N-Bromosuccinimida (NBS). También es posible hacer la reacción de sustitución usando la N-Clorosuccinimida. Todo dependerá del tipo de derivado halogenado que necesitemos. Recordemos que el halógeno puede reaccionar teóricamente con cualquiera de los hidrógenos presentes en el alqueno, sin embargo, el uso del bromo puede reportar la ventaja adicional de que es más selectivo que el cloro. Siempre el radical halogenuro sacará aquel hidrógeno cuya energía de enlace sea la más pequeña y el hidrógeno alílico, es decir, aquel que está unido al carbono vecino al del doble enlace, presenta en forma notable esa característica. Por ejemplo, en el siguiente alqueno: 104 hidrógeno alílico E= 87 kcal/mol hidrógeno 2º E= 95 kcal/mol H H H hidrógeno vinílico E= 108 kcal/mol H H Energías de los diferentes t ipos de enlaces C-H. Diagrama Nº7 6a.- Halogenación alílica (Br2, NBS.) Esta reacción es muy útil en síntesis y consiste en halogenar el carbono vecino al doble enlace. Desde luego, es necesario que ese carbono tenga al menos un átomo de hidrógeno. La presencia de NBS (N-bromosuccinimida) en la reacción, permite que haya una bajísima concentración de bromo (Br2) en el medio, que de lo contrario se adicionaría al doble enlace. Al comienzo de la reacción, una pequeña cantidad de bromo en CCl 4 da inicio a las etapas restantes de la halogenación según el mecanismo: Br2 (A) hv 2 Br El bromo radical generado en la etapa de inicio, extrae el hidrógeno más débilmente enlazado a la molécula, generando a su vez un radical arílico y una pequeña cantidad de ácido bromhídrico. H H (B) H + + Br HBr Esta pequeña cantidad de ácido bromhídrico es inmediatamente atrapada por la NBS liberando a su vez una pequeña cantidad de bromo, el que es suficiente como para producir la sustitución pero no la adición al doble enlace. O O (C) HBr + N O Br Br2 + N H O Esta es la importancia de la presencia del reactivo NBS en la reacción de sustitución. 105 H H (D) Br-Br + Br + Br Luego se repite el paso (B), (C) y (D) sucesivamente. Esquema Nº26 7.- REACCIÓN DE CICLOADICIÓN (DIELS ALDER): 7a.- Diels - Alder. (Reacción entre un dieno y un dienófilo) Fue descrita por primera vez en el año 1928, por los químicos alemanes Otto Diles y Kart Alder. Es tal la importancia que tiene esta reacción en síntesis, que a ambos se les otorgó posteriormente en el año 1950 el premio Nóbel de química. Es una de las pocas reacciones que permite obtener ciclos, anillos biciclos, triciclos etc. no saturados, al crear dos nuevos enlaces c-c intermoleculares a expensas de un par de dobles enlaces conjugados del sustrato dieno y un doble o triple enlace perteneciente al dienófilo involucrados. El producto obtenido se le llama comúnmente aducto o cicloaducto. Aquí se muestra esta reacción de una manera muy simplificada, aunque los resultados de estas pueden representar bastante bien lo que acontece en la realidad. + + dieno dienófilo reord. electrónico cicloproducto Esquema Nº27 La reacción entre butadieno como dieno y etileno como dienófilo, muestra la forma en que se redistribuyen los electrones involucrados para producir simultáneamente los dos nuevos enlaces. La reacción procede en forma concertada, vale decir, transcurre sin que se observe la formación de algún tipo de intermediario entre reactantes y aducto. ¿Qué factores favorecen esta reacción? En general esta reacción es acelerada por la presencia de sustituyentes dadores de electrones sobre el dieno y aceptores de electrones en el dienófilo: R1 R1 + + dieno R1 dienófilo reord. electrónico cicloproducto Aquí R1, es un grupo alquilo o un grupo dador, al igual que en el esquema siguiente 106 R1 R1 R1 + + dieno reord. electrónico dienófilo cicloproducto Esquema Nº28 El siguiente es otro ejemplo de como puede operar un grupo funcional sobre la orientación entre las dos moléculas. Estos son ejemplos de estereoselectividad, es decir, las moléculas reaccionantes se aproximarán y se unirán a consecuencia de la presencia de los sutituyentes de la misma manera sin producir otros productos. NO2 NO2 + + R1 R1 R1 reord. electrónico dienófilo dieno NO2 cicloproducto Esquema Nº29 ¿Qué estructura podría tener el dienófilo? El dienófilo no siempre debe ser un alqueno. Puede ser un ciclo insaturado, alquino etc. En este último caso, después de la reacción, el producto conserva un doble enlace proveniente del dienófilo. R R H CN H R H CN + + dieno CN dienófilo reord. electrónico cicloproducto Esquema Nº30 Con relación al dienófilo es estereoespecífica. Por ejemplo, si un dienófilo de configuración cis o trans, se hace reaccionar con un dieno, este conserva su configuración en el aducto: CN CN CN CN + NC CN + CN CN El dieno debe ser de todas maneras s-cis (todo cis). El isómero s-trans no reaccionará al colocarlo frente a un dienófilo. 107 + Sin embargo una mezcla de s-cis y s-trans, sí lo harán y de una manera especial, produciendo un aducto llamado endo, como lo veremos posteriormente. + La adición del dieno sobre el dienófilo es del tipo syn. Por un solo lado del plano del doble enlace y conservando su estereoquímica, como ya lo habíamos visto. A B B A Otro hecho especial de esta reacción, también relacionado a su estereoselectividad es aquella en que la reacción del dieno sobre el dienófilo, además de ser estereoespecífica tiene otra exigencia que es la de preferir solo uno de los lados del plano determinado por el doble enlace en el dienófilo, y es aquel que produce el aducto endo, es decir, aquel en que los electrones de los sustituyentes del dienófilo quedan lo más cerca posible del doble enlace generado en el dieno. Por ejemplo: H CO2Et + H CO2Et H H + CO2Et CO2Et CO2Et H H CO2Et Exo Endo Hay que agregar que en la última reacción solo se produce el isómero Endo. El otro isómero Exo que se muestra no se produce. Veamos otro ejemplo: O + H H O O O O Endo O Como puede verse, el único aducto que se forma es el isómero Endo. 108 Un ejemplo de esta reacción con la formación de un biciclo a expensas del dieno que es un ciclo: + NO2 NO2 Esquema Nº31 Otro ejemplo de obtención de un biciclo donde el dienófilo es ahora un ciclo: + O O Esquema Nº32 También puede obtenerse un triciclo, dependiendo de la estructura de los reactivos. En este caso, el producto es también al igual que en los esquemas Nº31 y Nº32 el isómero llamado Endo, que como vimos anteriormente, implica una distribución espacial particular de una parte de la molécula con relación a la estructura del cuerpo principal de la molécula: + O O El otro producto posible es el Exo (Ver el esquema Nº33). Sin embargo, el isómero Endo es el preferido. O + O O O O O Esquema Nº33 PROBLEMAS: 1.-Haga un esquema de síntesis de (X) a partir de 3,3-dimetilciclopenteno y cualquier otro reactivo orgánico o inorgánico necesario: 109 CH3 CH3 CH3 CH3 (X) 2.-Complete el siguiente esquema de síntesis, y dibuje las correspondientes a las señaladas en él, con las letras A, B, C, D, E y F. estructuras CN NBS (A) KOH/Etanol KMnO4, H (B) (C) (D) (C) (E) CN Br + 3.-A partir del compuesto (A) sintetizar y nombrar (B) C O ? C CH3 (A) CH2 CH3 (B) (F) 110 Y a partir de (B), sintetice y nombre (C). (C) CH3 H3C NO2 4.-Usando los reactivos orgánicos e inorgánicos que estime necesarios. Complete el siguiente esquema de reacción y dibuje las estructuras de (A),(B), (C) y (D). 1) Diels- Alder (A) + (B) 1.- NBS (C) 2) 3,3,6-trimetilciclohexeno (C) (D) + (E) 2.- KOH/Etanol (D) REACCIONA Diels-Alder 3) CH2 CH NO2 (E) NO REACCIONA Haga una breve explicación de cada etapa. 5.a) Escriba el nombre IUPAC correcto para el compuesto (A) y b) Dibuje la estructura de 5-metilbiciclo[ 2.2.2 ] 2-octeno CH(CH3)2 (A) 6.-. a) Asigne la configuración E,Z del siguiente compuesto insaturado: 111 CH3 C6H6 C CH b) De una breve justificación de su elección. 7.- ¿Cual sería el producto principal (alqueno) que se obtendría al tratar con ácido sulfúrico el siguiente alcohol: CH3 CH OH CH3 a -Dibuje su estructura. Y b.-Nómbrelo según IUPAC. 8.- ¿Cuantos productos esperaría usted de la reacción entre: 3-metilciclohexeno y ácido bromhídrico? a.- Dibuje su(s) estructura(s). Y b.- Nómbrelo(s) según IUPAC. 9.- Se trata de obtener el siguiente halogenuro de alquilo a partir de un alqueno por una reacción de adición. Br a) Escriba la estructura de los alquenos precursores posibles. (Dibújelos) b) Justifique la estructura del alqueno elegido (De al menos un argumento) 112 10.- a) ¿Cuál es el producto principal de la reacción? (dibuje las estructuras posibles). CH3 ? + HBr b) ¿Por qué la estructura que usted ha elegido es el producto principal de la reacción? (De al menos un argumento) 11.- La deshidratación del 2-metil-3-pentanol con ácido sulfúrico concentrado produce varios alquenos. a)-Dibuje las estructuras de todos aquellos posibles de esperar con esta reacción. b)-Diga cual de todos ellos es el alqueno que se producirá en mayor cantidad. Es decir, cuál es el producto principal de la reacción. 12.- a) Asigne la configuración E,Z del siguiente compuesto insaturado: CH3 N(CH3)2 C6H6 C CH NO2 b) De una breve justificación de su elección. 13.- a).- Clasifique de mayor a menor las prioridades de los siguientes cuatro sustituyentes según las reglas CIP, dando un argumento que justifique su elección. O C CH2NH2 (1) CH CHCH3 (2) C (3) NCH3 C CCH3 (4) b).-Colóquelos alrededor de un doble enlace de tal manera de obtener un compuesto E según CIP. 113 14.a) Proponga y dibuje los reactivos (A) y (B) que hagan posible la síntesis de (C), según el método de Diles-Alder. CH3 (C) NO2 b) Nombre según IUPAC el compuesto (A), (B) y (C) 15.- Dibuje un esquema de transformación de (cis)-2-penteno en (trans)-2-penteno 16.- Haga un esquema de síntesis para obtener el trans-2-penteno a partir de acetileno y cualquier reactivo orgánico e inorgánico necesario. 17.- a).- Proponga un nombre para el compuesto (A), incluyendo la configuración E o Z donde sea pertinente. H3C C C H3C C C C C CH3 C C CH CH2 CH2CH3 (A) b).- Escriba los productos de la reacción al tratar (A) con KMnO4 en medio ácido. 18.- Complete el siguiente esquema de síntesis, asignando: a) La estructura correcta a cada una de las letras que aparecen en las ecuaciones. b) Los nombres según las reglas IUPAC, incluyendo entre ellos, el producto final del esquema y las configuraciones de todos los centros asimétricos que haya. 114 1) Ph3P ) BuLi 2 CH3CHCH2CH2CH (A) CHCHO Br O Ph3P (A) + (B) (B) + (C ) CH3 NO2 19.- Obtener (X) a partir de 3,3-dimetilciclopenteno y cualquier otro reactivo orgánico o inorgánico necesario: CH3 CH3 CH3 CH3 (X) 20.- A partir del compuesto (A) sintetizar y nombrar (B) C O ? C CH3 (A) Y a partir de (B), sintetice y nombre (C). CH2 CH3 (B) 115 (C) CH3 H3C NO2 Usando los reactivos orgánicos e inorgánicos que estime necesarios
