proyecto semestral - Universidad Nacional Agraria La Molina
Anuncio

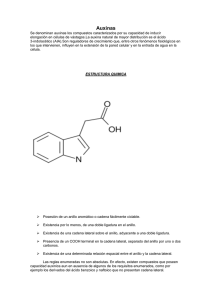
UNIVERSIDAD NACIONAL AGRARIA LA MOLINA CURSO: PRINCIPIOS DE PROPAGACION DE PLANTAS ALUMNO: EDUARDO SCHEFFER PEREZ TEMA: AUXINAS Y SUS EFECTOS SOBRE EL ENRAIZAMIENTO PROFESOR: DR. FRED DAVIES GRUPO: “G” 950632 PROYECTO SEMESTRAL AG – 3030 Principios de Propagación de Plantas Por: Eduardo Scheffer Pérez Tema: Auxinas y sus efectos sobre el enraizamiento Resumen: El descubrimiento de las auxinas trajo consigo una serie de estudios y trabajos. El holandés Fritz Went dio el primer paso al descubrir sustancias que actuaban sobre el enraizamiento. Otros investigadores como Thimann realizaron estudios con estas sustancias; a las cuales se les denominó como ANA y AIB (auxinas); descubriendo que estas se encuentran en diferentes concentraciones dentro de la planta y concluyó que la raíz trabaja a concentraciones muy bajas de auxinas. Las auxinas ayudan al crecimiento radicular hasta cierto máximo de concentración, ya que se pueden volver tóxicas a concentraciones elevadas. Esta toxicidad generalmente ocurre entre los 25 a 50 mg/l. Las auxinas son biosintetizadas a partir del aminoácido triptófano en 4 diferentes rutas: ruta del ácido indolpirúvico, de la triptamina, de la indolacetoxima y de la indolacetamida. Aún no se sabe con exactitud el tejido u órgano responsable de la biosíntesis de auxinas en condiciones naturales. Existen ciertas hipótesis sobre la biosíntesis de auxinas, las cuales hacen referencia a la muerte celular, la cual trae como consecuencia la liberación de triptófano por autolisis de proteínas; lo cual incrementa la concentración de triptófano en el medio y se da la síntesis de AIA. Para conocer la forma de transporte de las auxinas, se realizaron diversos estudios basados en los trabajos de Went. El transporte de las auxinas es polar; quiere decir, que desde el ápice del tallo al cuello de la planta es basipeto o basipétalo y desde el cuello a la raíz es acropeto o acropétalo. Esto se explica por la diferencia de potencial eléctrico del tallo, el cual es positivo en la base y negativo en el ápice; el AIA es electronegativo y por lo tanto es repelido por las células apicales y atraído por las basales. La concentración de auxinas en la planta está controlada por diversos sistemas; los cuales pueden ser: enzimáticos, formación de complejo con auxinas, etc. Se ha observado que las auxinas sintéticas son más estables que las naturales, ya que existen pocas enzimas que las afecten; por lo tanto estas tienden a acumularse en los tejidos de la planta y pueden llegar a ser tóxicas. Las auxinas provocan la elongación celular; para esto se deben ablandar las paredes celulares. Este proceso esta mediado por la salida de iones hidrógeno; los cuales acidifican el medio; al parecer la salida de iones hidrógeno es provocada por un RNA específico. Las auxinas tienen un efecto adicional, que es la síntesis de RNA y proteínas. Las auxinas que han probado ser mejores para inducir enraizamiento son el ácido indolbutírico (AIB) y el ácido naftalenacético (ANA); el AIB se ha utilizado desde 1930 por los propagadores de plantas para el enraizamiento de estacas. Es mejor utilizar soluciones de auxinas en agua; ya que las soluciones en alcohol pueden resultar tóxicas o quemar la planta. Los métodos de aplicación de estas soluciones para el enraizamiento de estacas son: inmersión, inmersión total, inmersión rápida y Spray drip down. Se realizó un trabajo con Agrobacterium rhizogenes y se observó una producción de AIA por las zonas infectadas. Referencias: - Barcelló Coll. Fisiología Vegetal.1992. - Rojas Garcidueñas. Fisiología vegetal Aplicada. Cuarta edición. 1993. - http://www.ashs.org/serialpubs/hortscience/hortscience.html - http://www.rooting-hormones.com/ - http://growertalks.com/ CONTENIDO: 1) Definición general del término FITORREGULADORES. 2) Descripción general de las auxinas: a.- Descubrimiento b.- Extracción y valoración de auxinas c.- Curva óptima de crecimiento d.- Localización de la auxina e.- Biosíntesis de la auxina f.- Transporte de las auxinas g.- Catabolismo auxínico h.- Mecanismo de acción 3) Métodos utilizados para la aplicación de soluciones auxínicas. 1) Definición del término fitorreguladores: Went y Thimann definieron a las hormonas de crecimiento como “sustancias que siendo producidas en una parte de un organismo son transferidas a otra y éstas influencian un proceso fisiológico específico”. Es por esta razón que Bidwell en 1979 dijo que las sustancias del crecimiento son extraídas de los tejidos vegetales y las sustancias sintéticas con efectos reguladores no pueden ser llamadas hormonas; y por lo tanto utiliza el término “regulador del crecimiento vegetal” o FITORREGULADORES. Los reguladores de crecimiento juegan un papel principal en el control del crecimiento no solo en la planta como un todo, sino también al nivel de órgano, tejido y célula; ya que la mayor parte de la actividad fisiológica de las plantas esta mediada por los fitorreguladores. Los fitorreguladores son sustancias mensajeras activas a muy bajas concentraciones (en su mayoría); siendo los lugares de síntesis y de acción distintos y en algunos casos activos en el mismo lugar de formación. Actualmente se conocen cinco tipos básicos de fitorreguladores; divididos en tres grupos: - Promotores del crecimiento auxinas, citoquininas y giberelinas. Inhibidores del crecimiento ácido abscíco. Etileno. 2) Descripción general de las auxinas: a.- Descubrimiento.El holandés Fritz Went, en el año de 1926, trabajaba de día y estudiaba por las noches en la universidad. Went estaba interesado en los experimentos científicos realizados por un grupo de botánicos europeos. Estos científicos habían realizado investigaciones acerca de los reguladores de crecimiento de plantas. Went trabajó con avena y descubrió sustancias que actuaban sobre el enraizamiento. Luego en 1934 – 1935 se nombraron a estas sustancias como ANA y AIB. Antiguamente se pensaba que solo eran producidas en el ápice del coleóptilo de avena; pero actualmente se sabe que las auxinas están presentes en las plantas superiores. b.- Extracción y valoración de auxinas.Los trabajos de Thimann demostraron que las auxinas se encuentran en las plantas de tres formas: una de fácil extracción por métodos de difusión, otra algo más difícil de extraer que requiere del empleo de solventes orgánicos y una tercera forma de auxina cuya extracción requiere de métodos enérgicos como la hidrólisis con NaOH o el empleo de enzimas proteolíticas. De aquí surgió el concepto de auxina ligada, de tal forma que ésta sería la auxina fisiológicamente activa. Aunque algunos autores afirman que las hormonas se encuentran en la planta de dos formas: libre y ligada; la forma libre es la activa y la forma ligada es de transporte y almacén. La forma libre debe ligarse a un receptor; molécula proteica que se encuentra en el sitio de acción; a partir de la cual tiene una acción sobre el DNA o RNA sea directamente o a través de una molécula mensajera. c.- Curva optima de crecimiento.En todos los ensayos que se han realizado para medir la elongación; el tejido crece a medida que lo hace la concentración de auxina hasta un nivel máximo. En este punto hay una inflexión y al aumentar la concentración, la elongación disminuye. En el caso de las auxinas, la toxicidad se alcanza a 25 – 50 mg/l, pero depende del pH, del efecto tampón, del tiempo de experimentación y de la presencia de ciertos iones. d.- Localización de la auxina.Gracias a las modernas técnicas de análisis y valoración de las auxinas, se pudo estudiar el contenido de AIA en diferentes tejidos vegetales. Así se ha podido demostrar que las auxinas se encuentran ampliamente distribuidas en el reino vegetal. Las cantidades de AIA que se miden varían entre 1 y 100 µg por Kg de peso seco; aunque con la modernización de las técnicas de extracción y corrección de las pérdidas a lo largo del proceso, los valores máximos en algunos tejidos pueden ser hasta tres veces mayores. En cuanto a la distribución de la auxina en los distintos tejidos u órganos, se ha visto, utilizando el test de epicótilo de guisante, que en la plántula de trigo existía alto contenido en el ápice del coleóptilo que iba disminuyendo a medida que se descendía hasta alcanzar la base y se incrementaba a medida que se avanzaba hacia el ápice de la raíz; siendo el valor en este punto menor que el que existe en el ápice del coleóptilo. e.- Biosíntesis de la auxina.El AIA se sintetiza a partir del aminoácido triptófano. Esta transformación también la puede realizar ciertos microorganismos. El triptófano está compuesto por un grupo indol y está universalmente presente en los tejidos vegetales, ya sea en forma libre o incorporada. La auxina es sintetizada por la planta en las células del meristemo apical del talluelo, tallo y ramas y en las yemas cuando están en desarrollo. Existen varias rutas de síntesis para la auxina; estas son: - - - Ruta del ácido indolpirúvico Esta es la vía general para eucariotas y muchos microorganismos. Esta ruta es considerada como la más importante en la biosíntesis del AIA. Ruta de la triptamina La triptamina se ha detectado en algunas plantas, concretamente poáceas. Ruta de la indolacetoxima Esta es una vía característica de las Brasicáceas. En el género Brassica se encuentra indolacetonitrilo, indolacetaldoxima y glucobrasicina. Estas tres sustancias son activas en promover el crecimiento en varios bioensayos. Ruta de la indolacetamida Presente en procariotas y en plantas transformadas por Agrobacterium donde coexiste con la ruta del indolpirúvico. Aún no está definido el lugar exacto (órgano o tejido) de la biosíntesis de la auxina en condiciones naturales. Aunque se han realizado diversos estudios sobre la distribución de la auxina planta; estos solo han dado a conocer el balance entre síntesis, metabolismo y transporte, tanto de entrada como de salida. Se piensa que el AIA del tallo procede de otros lugares de síntesis, aunque algo puede sintetizarse in situ; y probablemente esta capacidad sea mayor en tallos jóvenes. La producción de auxinas puede estar ligada al cambium, de tal forma que la autolisis del contenido celular de células del xilema en diferenciación liberen triptófano; el cual es transformado en AIA. También se ha encontrado AIA en las hojas y parece que su contenido decrece con la edad, aunque puede haber un nuevo aumento en tejido senescente, probablemente a causa del aumento de triptófano como consecuencia de la proteolisis. En raíces se ha encontrado AIA; aunque parece que procede de las partes aéreas. Hay que considerar la posibilidad de que los elevados niveles de AIA en tejidos jóvenes pueden ser consecuencia de la presencia de sustancias protectoras que eviten su oxidación; y no de una elevada actividad biosintética. En conclusión; se puede decir, que los sitios más importantes para la síntesis de auxinas son: las hojas jóvenes en expansión, el tejido cambial, los ovarios inmaduros y semillas en desarrollo. Sin embargo, otros tejidos pueden tener la capacidad de producir auxinas, aunque no son tan importantes, estos son: hojas maduras, tallos y raíces. Existe una hipótesis basada en que los lugares de síntesis activa de auxinas están asociados con la muerte de las células, ya sea durante la diferenciación vascular, la digestión del endospermo o la senescencia de las hojas. Según esto, el triptófano es el factor limitante para la síntesis de auxinas y el nivel del triptófano en células vivas es normalmente demasiado bajo para que se pueda dar la síntesis. Al morir la célula se libera triptófano mediante autolisis de las proteínas, lo que hace que aumente la concentración del triptófano y se pueda realizar la síntesis de AIA. f.- Transporte de las auxinas.El transporte de las auxinas se puede estudiar mediante diversas técnicas; una de ellas consiste en la aplicación de una auxina exógena, natural o sintética, marcada o no, a una planta intacta o segmento de coleóptilo, tallo o raíz y medir el tiempo que tarde esa auxina en recorrer una distancia. Básicamente, todas las técnicas están basadas en los trabajos de Went. Consiste en poner un bloque de agar donador que contiene auxina en el extremo del tejido y un bloque de agar receptor en el otro extremo del tejido; pudiéndose medir el contenido de auxina en el bloque receptor a diferentes intervalos de tiempo. Con estos estudios se ha llegado a la conclusión de que la velocidad de transporte es: - Independiente de la longitud del tejido. Independiente de la concentración de auxinas en el bloque donador, lo que a su vez nos indica que no se trata de un proceso de difusión. Varía con la edad y tipo de tejido. Está influida por la temperatura. Lo que hace peculiar al transporte de auxinas es que se realiza de forma polar; quiere decir, que en el tallo se dará en dirección basipétala y en la raíz en dirección acropétala. El transporte polar ocurre por la diferencia de potencial eléctrico del tallo, el cual es positivo en la base y negativo en el ápice; como el AIA es un ácido, resulta ser electronegativo y es repelido por las células apicales y atraído por las basales. Esta polaridad del transporte se mantiene aun si el tejido vegetal (tallo) es cortado y colocado de cabeza. Por otro lado, se ha demostrado que la falta de oxígeno afecta o inhibe el transporte polarizado, que es incrementado por la luz y que es sensible a la temperatura. Las auxinas no se trasladan principalmente por el xilema o floema; su movimiento se da célula a célula en la corteza, médula o parénquima. Su movimiento es activo y no pasivo; es decir, que las células que transportan auxinas deben estar respirando. Aun en distancias cortas, su movimiento es aproximadamente diez veces más rápido que la difusión. En plantas intactas, la dirección del movimiento depende de la zona de aplicación de la hormona y se desplaza desde el lugar de aplicación hasta el lugar de consumo. Así, si se aplica una auxina en hojas adultas, irá a donde vayan los productos de la fotosíntesis que esa hoja exporta a través del floema. Existen trabajos que apoyan la presencia de auxinas en la corriente transpiratoria del xilema. g.- Catabolismo auxínico.La concentración de auxinas en la planta no solo se regula por la tasa de síntesis y la velocidad de transporte hacia y desde el órgano que se considere, sino por los mecanismos de inactivación; de hecho, está claramente demostrado que el AIA es inactivado fácilmente por casi todos los vegetales. La degradación enzimática del AIA puede ejercer un papel regulador del nivel de auxinas en las plantas. Existen pruebas que parecen demostrarlo; por ejemplo al aumentar la edad de los tejidos aumenta también la actividad de la AIA oxidasa, hay una relación inversa entre la tasa de crecimiento y el contenido de AIA oxidasa en distintos órganos y por último en raíces hay muy poco AIA y valores muy altos de actividad de AIA oxidasa; sin embargo aun no se ha demostrado la importancia fisiológica de tales correlaciones. Las auxinas sintéticas son más estables que las naturales, debido a que existen pocos sistemas enzimáticos que las ataquen fácilmente, por lo que tienden a acumularse, al punto de llegar a ser tóxicas. En general, los tejidos pueden regular la actividad auxínica por medio de cuatro sistemas de control: - Ligando al regulador en algún sitio del citoplasma. Convirtiéndolo en algún tipo de derivado. Degradándolo. Eliminándolo por medio de la excreción. h.- Mecanismo de acción.Las plantas poseen un sistema hormonal de comunicación a larga distancia, mediante el cual las células diana traducen la señal hormonal en una respuesta específica. Aunque se desconoce cuáles son los mecanismos que regulan esta transmisión se piensa que pueden parecerse a los que funcionan en los animales. Estos receptores específicos de auxinas en la célula vegetal son tan precisos que se piensa que son proteínas. El problema está en la localización subcelular de estos receptores. Estas proteínas receptoras se unen de forma específica y reversible a la señal química; tras realizarse la unión experimentan un cambio conformacional, pasando de una forma inactiva a una forma activa. Al suministrarle auxina a un tejido se observan respuestas en periodos cortos, inferiores a los 15 minutos y para poder observar otros hay que dejar transcurrir periodos más largos de tiempo. Se suponía que las primeras ocurrían antes de que fuera posible una activación genética por efecto de la auxina; pero esta suposición esta sometida a muchas discusiones. Cuando se aplica auxina a un tejido con capacidad de respuesta de crecimiento hay un periodo de latencia de duración variable antes de que aumente la tasa de crecimiento. Tras ese periodo, que casi nunca es inferior a los 8 minutos, la tasa de crecimiento aumenta rápidamente durante 30 – 60 minutos hasta alcanzar el máximo; posteriormente la tasa de crecimiento se puede hacer estable, alcanzar un segundo máximo o disminuir. El periodo de latencia varía de acuerdo al tejido, aumenta al disminuir la concentración de auxina o se alarga al disminuir la temperatura; pero el periodo de latencia no puede ser eliminado. Las auxinas provocan la elongación celular. La aplicación de auxinas a plantas intactas no incrementa la elongación de las células de manera uniforme. En una planta normal, aunque los niveles de auxinas no son uniformes en todos los tejidos, aparentemente se encuentran en los niveles ideales. Durante la elongación, las células absorben agua por ósmosis. Esto hace que el potencial hídrico sea ligeramente menor (más negativo) en el interior celular que en el medio externo. Durante el crecimiento celular inducido por auxinas, la concentración de los solutos permanece constante. Cuando entra el agua a la célula, se absorben solutos del exterior, o se pueden producir metabólicamente en su interior, de tal modo que se mantiene la concentración osmótica. Entonces la concentración de los solutos no se incrementa lo suficiente como para dar al crecimiento celular. En cambio las paredes celulares se reblandecen. Esto reduce la presión, disminuyendo el potencial hídrico y permite que la célula absorba agua y crezca. Desde la década de 1930 se sabía que la auxina incrementa la plasticidad (estiramiento irreversible) de la pared celular. La auxina provoca la secreción de iones hidrógeno de la membrana celular hacia las paredes y la presencia de iones hidrógeno (mayor acidez) reblandece de alguna forma la pared celular: La aplicación de iones hidrógenos desde el exterior también puede reblandecer las paredes celulares y causar el crecimiento celular. Al parecer la inducción rápida de un RNA específico que impacta la secreción de iones hidrógeno y el alargamiento celular al regular la secreción de materiales para formar la nueva pared por medio de la regulación de polipéptidos que actúan en sistemas de la HATP asa. Las auxinas pueden intervenir o no en la elongación de las células radiculares durante el crecimiento de las plantas normales. Las auxinas parecen tomar parte en la división y diferenciación celular que llevan a la formación de raíces secundarias a partir de las raíces primarias, así como el desarrollo de raíces adventicias. Durante la formación de raíces adventicias en tallos tratados con auxinas, las células inicialmente se dividen en forma desorganizada para dar lugar a una masa de tejido que semeja u tumor y que recibe el nombre de callo. Después se forman los primordios radiculares organizados dentro del callo. Muchas estacas de plantas pueden generar raíces si se colocan en medios húmedos, como arena; sin embargo, al tratar estas estacas con auxinas (en general se emplea el AIB, que es sintético, en lugar de AIA), se acelera el proceso de enraizamiento y se promueve la formación de raíces más gruesas; por otra parte, puede provocar el enraizamiento de especies que normalmente no forman raíces. Este tipo de propagación vegetativa es un ejemplo de clonación. Para mantener un crecimiento continuo es necesaria la síntesis de RNA y proteínas, pero además está demostrado que las auxinas pueden estimular la síntesis de proteínas y RNA en tejidos en crecimiento. Así en cultivos de médula de tabaco el crecimiento aumenta al añadir AIA y este aumento es precedido de un aumento proporcional del RNA; el máximo de este aumento se consigue a la concentración de AIA que produce un crecimiento máximo. Mediante experimentos complejos con extractos libres de células se han estudiado los cambios en los perfiles de proteínas como consecuencia de la traducción in vitro. Se ha visto que hay cambios en los productos de traducción que pueden ocurrir rápidamente tras la aplicación de auxina. La regulación de las auxinas puede tener lugar a través de la regulación de la síntesis de RNA y por lo tanto de la síntesis de proteínas. De hecho se ha visto en los distintos tipos de RNA un aumento por influencia de la auxina, especialmente en la fracción ribosómica; por lo tanto esta debe ser la fracción implicada en el proceso de crecimiento. La fracción ribosómica es la que tiene el m-RNA, lo que indica que la inhibición de crecimiento por inhibidores de la síntesis de ácidos nucleicos será posible si afectan a la fracción de m-RNA Estos hechos llevaron a proponer una hipótesis de activación genética; según esto, la auxina desprimía ciertos genes cuya expresión era necesaria para el proceso de extensión y se traducía en la aparición de proteínas y RNA específicos, fundamentalmente r-RNA, aunque también se detectaron cambios en el m-RNA y t-RNA. Sin embargo, hay una serie de trabajos con inhibidores específicos de la síntesis de RNA en que aun inhibiendo la síntesis de RNA, el crecimiento no se ve afectado; sin embargo, sí se inhibe cuando se aplica actinomicina D que inhibe la síntesis de RNA. Un posible receptor de las auxinas se encuentra en el plasmalema. Morré y colaboradores han propuesto que las membranas plasmáticas de células de soja contienen un factor regulador que es liberado específicamente por las auxinas y que estimula la actividad de la RNA – polimerasa. Esta interacción auxina/plasmalema podría transmitirse al núcleo al liberar un receptor que interacciona con una RNA – polimerasa específica. Como consecuencia, se alteraría la transcripción de DNA y se producirían cambios cualitativos y cuantitativos en la síntesis de RNA. Podría darse un paso más y suponer que la interacción de la auxina con el receptor libera iones hidrógeno del plasmalema en la pared celular y como consecuencia del descenso del pH, se produce el reblandecimiento de la pared celular. Las auxinas y el etileno están implicadas en la regulación de la formación de raíces adventicias. Aparentemente los efectos de la auxina están mediados por la acción del etileno, aunque la acumulación de auxinas estimula la biosíntesis del etileno y este último bloquea el transporte polar de las auxinas. 3) Métodos utilizados para la aplicación de soluciones auxínicas: Desde el año 1930 el regulador de crecimiento AIB ha sido utilizado para el enraizamiento de estacas. Las soluciones de AIB disueltas en agua para muchos propósitos; incluso mucho más que otros componentes. Las concentraciones utilizadas para el enraizamiento varían entre 10 a 20000 ppm de AIB. El método de aplicación y la concentración del AIB está determinado por el tipo de planta (variedad), condiciones para la propagación, estación del año, etc. Los métodos utilizados para la aplicación de auxinas en estacas para enraizamiento son: inmersión, inmersión total, inmersión rápida y Spray Drip Down. Las auxinas disueltas en agua son más efectivas para el enraizamiento que las auxinas disueltas en alcohol; el AIB es más utilizado que el ANA o AIA. Las soluciones de auxinas en alcohol pueden deshidratar a la planta, ser tóxicas para la parte basal del tallo u otros tejidos de la planta. Cuando el alcohol se evapora rápidamente sobre la planta, entonces la concentración de la auxina se incrementa, pudiendo llegar hasta un máximo en el cual ya se vuelve inhibitoria para el enraizamiento. El silicato de magnesio (talco) mezclado con AIB es utilizado para el método de inmersión en seco; el cual consiste en introducir ¾ “ de la estaca en el polvo antes de sembrar la estaca. Es importante que el polvo se adhiera de forma uniforme en la parte basal de la estaca. Resulta difícil relacionar las concentraciones de las sustancias enraizadoras en polvo y en líquido; por lo que la elección depende del método de aplicación, retención y tejido de la planta que se utilice. El método de inmersión se utiliza para estacas difíciles de enraizar y consiste en la inmersión de la parte basal de la estaca en la solución por 4 a 12 horas. Las estacas son plantadas inmediatamente después del tratamiento. El método de inmersión rápida es preferido por muchos propagadores para el enraizamiento de estacas. Para este método se utiliza una solución muy concentrada de auxina; en la cual se introduce la parte basal de la estaca por unos segundos. Las estacas son plantadas inmediatamente después del tratamiento. El método de inmersión total de la estaca produce muy buenas raíces. Para esto se debe sumergir la estaca completa en la solución por unos segundos. Las estacas son plantadas inmediatamente después de esto. Las estacas pueden ser sumergidas hasta por 2 minutos en una solución a 1000 ppm a base de AIB disuelto en agua. Este método incrementa el peso fresco de las raíces en comparación con el método de inmersión en seco. El método Spray Drip Down consiste en la aspersión de la solución sobre las hojas y tallo de las estacas que previamente han sido plantadas en grandes bandejas. Esta aspersión se realiza hasta que la solución gotee y haga contacto con el medio de enraizamiento. Este método resulta ser más efectivo ya que requiere de menos labores y de una menor concentración de la solución de auxinas. Un método poco común es la utilización de bacterias (Agrobacterium rhizogenes); se realizó un experimento en estacas de tallo de nuez. En este experimento se vio que la bacteria rhizogenes promovía la formación de raíces adventicias en las zonas de infección. Este enraizamiento es resultado de la transferencia de un gen de la bacteria (T-DNA) hacia el genoma de la planta. En respuesta la planta produce AIA y como resultado se da la formación de raíces. Bibliografía consultada: - El ingeniero Agrónomo. VADEMECUM AGRARIO. 97/98. - Daniel V. Hurtado. Cultivo de tejidos vegetales.1997. - Barcelló Coll. Fisiología Vegetal.1992. - Rojas Garcidueñas. Fisiología Vegetal Aplicada. Cuarta edición. 1993. - William A. Jensen, Frank B. Salisbury. Botánica. Segunda edición. 1990. - Nahla V. Bassil, William M. Proebsting, Larry W. Moore, David A. Lightfoot. 1991. Propagation of Hazelnut stem cuttings using Agrobacterium rhizogenes. Hortscience, Vol.26(8): 1058 – 1060. - Giovanni Iapichino, Tony H.H Chen, Leslie H. Fuchigami.1991.Adventitious Shoot Production from a Vireya Hibrid of rhododendron. Hortscience, Vol.26(5): 594 – 596. - K.H. Al-Juboory, D.J Williams and R.M Skirvin.1991.Growth Regulators Influence Root and Shoot Development of Micropropagated Algerian Ivy.Hortscience,Vol.26(8): 1079 – 1080. - Verónica T. Lewandowski.1991.Rooting and Acclimatization of Micropropagated Vitis labrusca ´Delaware´. Hortscience, Vol.26(5): 586 – 589. - Steven T. McNamara and Cary A. Mitchell.1991.Roles of Auxin and Ethylene in Adventitious Root Formation by a Flood – Resistant Tomato Genotype.Hortscience,Vol.26(1): 57 – 58. - http://www.Rooting-hormones.com/ - http://www.iarn.unl.edu/pubs/horticulture/g337.htm. - http://www.Growertalks.com/ - http://www.Ashs.org/serialpubs/hortscience/hortscience.html - http://www.telework.ucdavis.edu/root/pcsearch.htm - http://www.oliveoilsource.com/propagating.htm#propagating