INSTITUCIÓN EDUCATIVA JUAN DE LA CRUZ
Anuncio
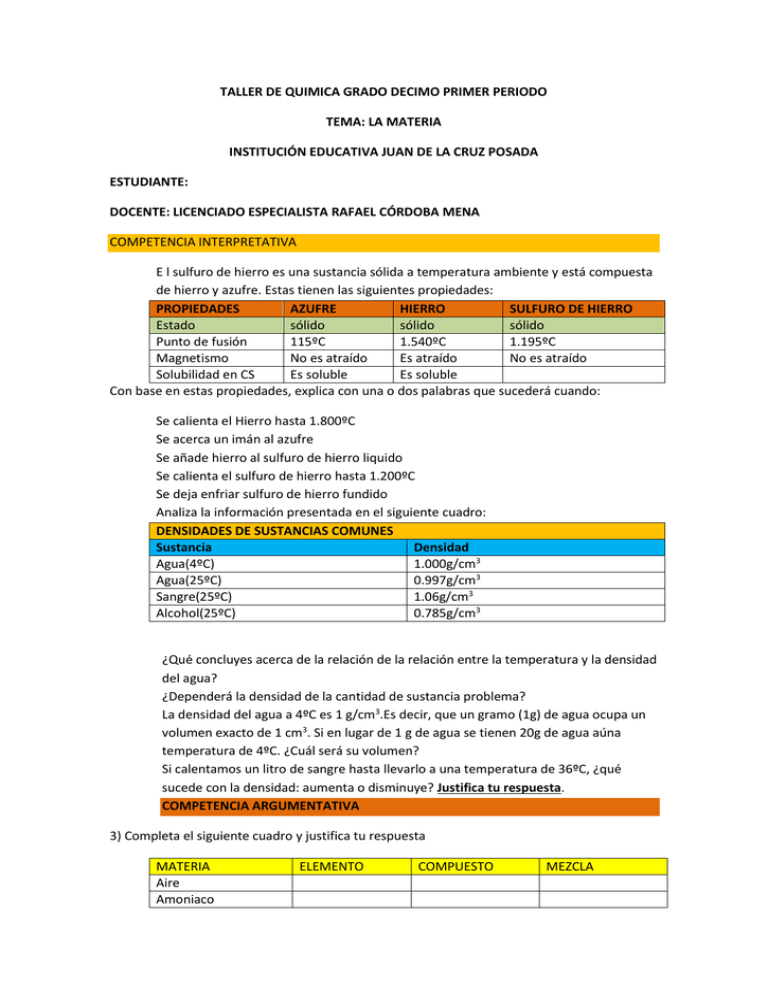
TALLER DE QUIMICA GRADO DECIMO PRIMER PERIODO TEMA: LA MATERIA INSTITUCIÓN EDUCATIVA JUAN DE LA CRUZ POSADA ESTUDIANTE: DOCENTE: LICENCIADO ESPECIALISTA RAFAEL CÓRDOBA MENA COMPETENCIA INTERPRETATIVA E l sulfuro de hierro es una sustancia sólida a temperatura ambiente y está compuesta de hierro y azufre. Estas tienen las siguientes propiedades: PROPIEDADES AZUFRE HIERRO SULFURO DE HIERRO Estado sólido sólido sólido Punto de fusión 115ºC 1.540ºC 1.195ºC Magnetismo No es atraído Es atraído No es atraído Solubilidad en CS Es soluble Es soluble Con base en estas propiedades, explica con una o dos palabras que sucederá cuando: Se calienta el Hierro hasta 1.800ºC Se acerca un imán al azufre Se añade hierro al sulfuro de hierro liquido Se calienta el sulfuro de hierro hasta 1.200ºC Se deja enfriar sulfuro de hierro fundido Analiza la información presentada en el siguiente cuadro: DENSIDADES DE SUSTANCIAS COMUNES Sustancia Densidad Agua(4ºC) 1.000g/cm3 Agua(25ºC) 0.997g/cm3 Sangre(25ºC) 1.06g/cm3 Alcohol(25ºC) 0.785g/cm3 ¿Qué concluyes acerca de la relación de la relación entre la temperatura y la densidad del agua? ¿Dependerá la densidad de la cantidad de sustancia problema? La densidad del agua a 4ºC es 1 g/cm3.Es decir, que un gramo (1g) de agua ocupa un volumen exacto de 1 cm3. Si en lugar de 1 g de agua se tienen 20g de agua aúna temperatura de 4ºC. ¿Cuál será su volumen? Si calentamos un litro de sangre hasta llevarlo a una temperatura de 36ºC, ¿qué sucede con la densidad: aumenta o disminuye? Justifica tu respuesta. COMPETENCIA ARGUMENTATIVA 3) Completa el siguiente cuadro y justifica tu respuesta MATERIA Aire Amoniaco ELEMENTO COMPUESTO MEZCLA Carbono Leche Gas Carbónico Agua Gaseosa 4) Con base en la información presentada en el siguiente cuadro Material obtenido Punto de ebullición(ºC) Asfalto 480 Aceite diesel 193 Nafta 90 a) Ordena las sustancias de menor a mayor de punto de ebullición b) ¿Cuál sería el orden de separación de las sustancias teniendo en cuenta sus puntos de ebullición? c) ¿Qué nombre recibe el método de separación de mezclas empleados? COMPETENCIA PROPOSITIVA 5. Diseña un experimento para determinar la densidad de un sólido irregular. Indica que materiales necesitarías. Escribe el procedimiento 6. Diseña un procedimiento para separar cada una de las mezclas que aparecen a continuación. Señala la técnica que emplearías y realiza un listado de los materiales que necesitarías a) Azufre, limpiadoras de hierro, sulfato de cobre. b) Aceite y agua c) Alcohol, aceite y agua 7. Si la densidad de los sólidos y los líquidos se expresan en g/L, establece el procedimiento para hallar la densidad de: a) una piedra preciosa en forma de cubo que tiene una arista que mide 0,20 cm y su masa es de 98.5mg. b) Una esfera de plomo cuyo radio es de 2.00 cm y pesa 1.5 kg c) 3.000 cm3 de aire que pesan 0.004 kg. 8. señala algunas diferencias y semejanzas entre: a) Sustancias puras y mezclas b) propiedades extensivas y propiedades intensivas c) Cambios físicos y cambios químicos d) Masa y peso e) Elemento y compuesto ANALIZA Y RESUELVE 9. Diseña un procedimiento para separar los componentes de las siguientes mezclas, e indica que material de laboratorio necesitarías. a) Una mezcla de aserrín y azúcar b) Una mezcla heterogénea de tres líquidos no miscibles: agua, aceite y mercurio c) Una mezcla de sal y azúcar. d) Una mezcla de harina y limadura de hierro 10. Indica cuál de los siguientes procedimientos es el más adecuado para para separar una mezcla de sal, azufre y gasolina. Justifica tu elección y explica por qué rechazas cada uno de los otros. a) Calentar para que la gasolina se evapore y separar después de la sal y el azufre añadiendo agua. Al filtrar quedaría el azufre en el papel y se separaría la sal del agua. b) Filtrar para separar la gasolina de los sólidos. Añadir agua sobre el mismo filtro para que se disuelva la sal y separarla del azufre por filtración. Recuperarla dejando evaporar el agua. c) Filtrar para separar la gasolina de los dos sólidos .añadir sulfuro de carbono sobre el filtro para disolver el azufre y luego por evaporación del sulfuro de carbono d) Calentar para que primero se evapore la gasolina y después se funda el azufre. 11. Señala cuáles de los siguientes procesos son cambios físicos y cuáles son cambios químicos a) Vaporización b) Mezcla en un recipiente de dos gases, oxigeno e hidrogeno c) Formación de agua al hacer saltar una chispa eléctrica en una mezcla de oxigeno e hidrogeno d) Oxidación del hierro e) Calentamiento de un trozo de aluminio 12. Di que cantidad de cada pareja representa un valor mayor. Justifica tu respuesta a) 2,4m y 24cm d) 2kg/m3 y 2.7g/cm3 b) 25ºC y 400K e) 10 L y 55dm c) 500kg y 0.75t f) 55mm y 0.55cm g) 1h y 86.400s h) 525 g y 0.5500kg 13. Con base en la gráfica responde las siguientes preguntas Masa (g) 600 Oro en polvo 500 Plata en polvo 400 Estaño en polvo 300 200 100 0 10 20 30 Volumen (cm3) a)¿Cuál es la densidad de cada metal? b) ¿Cuántas cucharaditas de 3 cm3 de volumen pueden tomarse con 176g de cada material? PROBLEMAS DE PROFUNDIZACION 14. ¿En qué valor las escalas ºF y ºC son numéricamente iguales? Con base en una gráfica estándar de, masa contra estatura, estatura escoge cinco compañeros de tu clase, anota su estatura y su masa. Haz una gráfica y compárala con la gráfica estándar. ¿Qué conclusión o conclusiones puedes plantear? MATERIA Y ENERGIA VERIFICACIÓN DE CONCEPTOS Indica si son verdaderas o son falsos los siguientes enunciados. Justifica tu respuesta Los cambios o transformaciones en la naturaleza suelen ir acompañados de cambios de energía El azúcar es una sustancia pura porque está formado por la misma cantidad de moléculas. La densidad es una propiedad extensiva porque depende de la cantidad de materia de la sustancia Un trozo de manzana expuesto al aire se ennegrece, esto indica que se lleva a cabo una reacción química. El peso y la masa son propiedades físicas de la materia, por lo tanto pueden variar en una misma cantidad de diferentes sustancias. Los cambios físicos son cambios reversibles, mientras que los cambios químicos no. PROBLEMAS BASICOS 1. Un científico recibió unas muestras metálicas para determinar si correspondían al mismo material. Decidió medir la masa y el volumen de cada muestra a fin de determinar su densidad. Los datos obtenidos son los siguientes: MUESTRA MASA(g) VOLUMEN(cm3) 1 18.36 6.8 2 41.18 15.4 3 73.98 27.4 4 8.64 3.2 5 45.09 16.7 a. Calcula la densidad e cada muestra b. Compara los valores obtenidos c. Haz un gráfico ubicando las masas en las ordenadas y volúmenes en las abscisas d. ¿Qué tipo de curva obtuviste? e. Analiza la curva obtenida:¿Qué relación existe entre la masa y el volumen? f. ¿Puedes concluir que las muestras pertenecen a la misma sustancia? justifica tu respuesta
