SÍNTESIS DE LA ASPIRINA
Anuncio
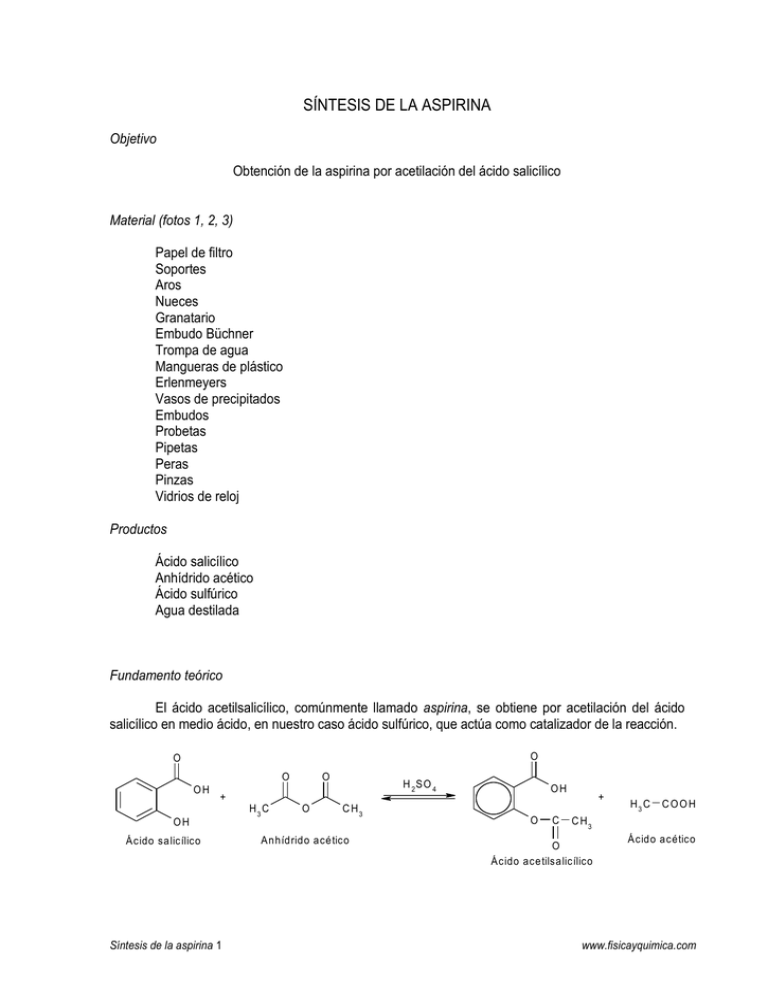
SÍNTESIS DE LA ASPIRINA Objetivo Obtención de la aspirina por acetilación del ácido salicílico Material (fotos 1, 2, 3) Papel de filtro Soportes Aros Nueces Granatario Embudo Büchner Trompa de agua Mangueras de plástico Erlenmeyers Vasos de precipitados Embudos Probetas Pipetas Peras Pinzas Vidrios de reloj Productos Ácido salicílico Anhídrido acético Ácido sulfúrico Agua destilada Fundamento teórico El ácido acetilsalicílico, comúnmente llamado aspirina, se obtiene por acetilación del ácido salicílico en medio ácido, en nuestro caso ácido sulfúrico, que actúa como catalizador de la reacción. O O O O OH + OH Ácido salicílico Síntesis de la aspirina 1 H3 C O H 2 SO 4 C H3 Anhídrido acético OH O C + H3 C COOH C H3 O Ácido acetilsalicílico Ácido acético www.fisicayquimica.com Las tabletas comerciales de aspirina se componen habitualmente de 0,32 g de ácido acetilsalicílico prensado junto a una pequeña cantidad de almidón, que sirve para darles cohesión. Se trata de un analgésico eficaz contra el dolor de cabeza, agente antiinflamatorio que proporciona alivio a la inflamación asociada a la artritis y heridas menores, además de antipirético, ya que reduce la fiebre. Procedimiento Añadimos a un erlenmeyer de 250 ml y en este orden, 5 g de ácido salicílico (Foto 4), 10 ml de anhídrido acético (Foto 5) y 1 ml de ácido sulfúrico concentrado (Foto 6). Al tratarse de una reacción fuertemente exotérmica, la temperatura se eleva mucho. El ácido salicílico se disolvió completamente y empezó a precipitar el derivado acetilado. Debido al incremento de temperatura de la reacción, no fue necesario calentar la mezcla para lograr la acetilación total, por lo que la pasamos rápidamente a un vaso de precipitados (Foto 7). Importante: ¡hay que tener mucho cuidado con los vapores producidos por el ácido sulfúrico! A continuación, y para acelerar el enfriamiento, aunque no es imprescindible, lo metimos en la nevera unos minutos. Después, depositamos el producto en un trozo de papel de filtro previamente pesado y de forma circular para poder introducirlo en el embudo Büchner (Foto 8). Con unas pinzas, pues el ácido acetilsalicílico obtenido está empapado de ácido sulfúrico, lo depositamos en el embudo Büchner y comenzamos a filtrar abriendo el grifo al que está conectada la trompa de agua. Podemos ir añadiendo agua destilada de vez en cuando sobre el producto para que vaya desapareciendo el ácido sulfúrico. Hay que hacerlo con cuidado para evitar perder parte del ácido acetilsalicílico obtenido (Foto 9). Después de unos minutos, y cuando se observa que el ácido salicílico ha perdido la mayor cantidad posible de líquido, sacamos el producto de la reacción y el trozo de filtro con unas pinzas y lo depositamos, junto con el filtro, en otro trozo de filtro previamente pesado, que irá colocado en el embudo para lavarlo con agua destilada (Foto 10). Lavamos con agua destilada las veces que fueron necesarias hasta que el olor del ácido sulfúrico desapareció. Se puede hacer tantas veces como sea necesario (Foto 11). Una vez terminado el proceso de lavado y filtrado, depositamos el ácido salicílico obtenido sobre dos hojas de papel de filtro para que la muestra obtenida se terminara de secar completamente. Al día siguiente pesamos el producto final totalmente seco (Fotos 12, 13). Resultados Masa del papel de filtro circular del embudo Büchner = 0,3 g Masa del papel de filtro del embudo de cristal = 4,9 g Masa total del producto con filtros = 7,1 g Ácido acetilsalicílico obtenido = 7,1 – (4,9 + 0,3) g = 1,9 g Síntesis de la aspirina 2 www.fisicayquimica.com Para calcular el rendimiento de la reacción, hay que tener en cuenta los datos de los productos químicos utilizados, que son: Ácido salicílico PANREAC, 99%, M = 138,12 Anhídrido acético PANREAC, 98%, d = 1,080 kg/l, M = 102,09 La ecuación química que representa la reacción está ajustada, ya que a partir de 1 mol de ácido salicílico y 1 mol de anhídrido acético se obtienen 1 mol de ácido acetilsalicílico y 1 mol de ácido acético. El volumen de anhídrido acético que usamos fue 10 ml, lo que equivale a una masa de m d V 1,080 g / ml 10 ml 98 100 10 ,58 g La masa de ácido salicílico usada fue de 5g 99 100 4 ,95 g A la vista de las cantidades empleadas y sus masas molares, está claro que el reactivo limitante es el ácido salicílico, pues si 1 mol de salicílico (138,12 g) reacciona con 1 mol de acético (102,09 g), los 5 g de salicílico que empleamos reaccionarán con 138 ,12 g salicílico 102,09 g acético 5 g salicílico x g acético x 5 102,09 138,12 g acético 3,70 g anhídrido acético Como hemos usado 10 ml, equivalentes a 10,58 g, sobrará anhídrido acético sin reaccionar. Además, sabemos que 1 mol de ácido acetilsalicílico equivale a 180 g. Por tanto, si a partir de 1 mol de ácido salicílico (138,12 g) se obtiene 1 mol de ácido acetilsalicílico (180 g), a partir de 4,95 g de ácido salicílico se deberían obtener teóricamente 138 ,12 g salicílico 180 g acetilsali cílico 4 ,95 g salicílico x g acetilsali cílico x 4,95 180 138,12 g acetilsali cílico 6,45 g acetilsali cílico Por tanto, al haber obtenido experimentalmente 1,9 g, el rendimiento fue 1,9 g 6,45 g 100 29,5 % IMPORTANTE: La aspirina obtenida sólo tiene valor académico, es decir, su utilidad es el procedimiento de obtención, además de tener restos de ácido sulfúrico. EN NINGÚN CASO DEBE CONSUMIRSE Síntesis de la aspirina 3 www.fisicayquimica.com
