modelo actual de la corteza atómica
Anuncio
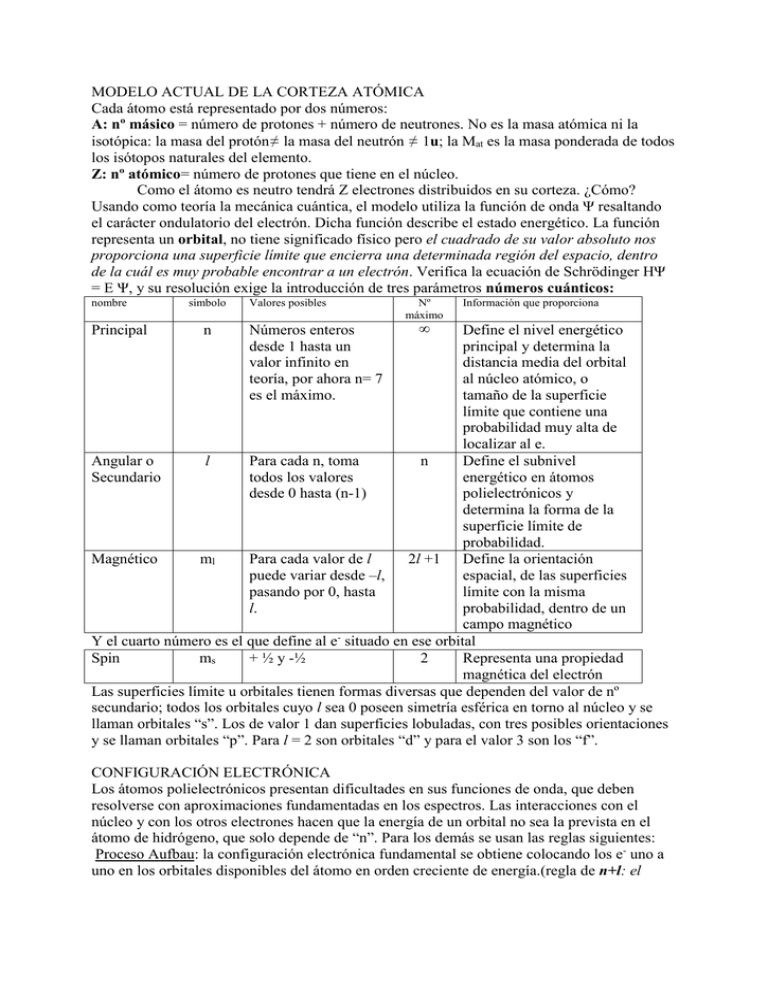
MODELO ACTUAL DE LA CORTEZA ATÓMICA Cada átomo está representado por dos números: A: nº másico = número de protones + número de neutrones. No es la masa atómica ni la isotópica: la masa del protón≠ la masa del neutrón ≠ 1u; la Mat es la masa ponderada de todos los isótopos naturales del elemento. Z: nº atómico= número de protones que tiene en el núcleo. Como el átomo es neutro tendrá Z electrones distribuidos en su corteza. ¿Cómo? Usando como teoría la mecánica cuántica, el modelo utiliza la función de onda Ψ resaltando el carácter ondulatorio del electrón. Dicha función describe el estado energético. La función representa un orbital, no tiene significado físico pero el cuadrado de su valor absoluto nos proporciona una superficie límite que encierra una determinada región del espacio, dentro de la cuál es muy probable encontrar a un electrón. Verifica la ecuación de Schrödinger HΨ = E Ψ, y su resolución exige la introducción de tres parámetros números cuánticos: nombre Principal símbolo n Valores posibles Números enteros desde 1 hasta un valor infinito en teoría, por ahora n= 7 es el máximo. Nº máximo Información que proporciona ∞ Define el nivel energético principal y determina la distancia media del orbital al núcleo atómico, o tamaño de la superficie límite que contiene una probabilidad muy alta de localizar al e. Angular o l Para cada n, toma n Define el subnivel Secundario todos los valores energético en átomos desde 0 hasta (n-1) polielectrónicos y determina la forma de la superficie límite de probabilidad. Magnético ml Para cada valor de l 2l +1 Define la orientación puede variar desde –l, espacial, de las superficies pasando por 0, hasta límite con la misma l. probabilidad, dentro de un campo magnético Y el cuarto número es el que define al e- situado en ese orbital Spin ms + ½ y -½ 2 Representa una propiedad magnética del electrón Las superficies límite u orbitales tienen formas diversas que dependen del valor de nº secundario; todos los orbitales cuyo l sea 0 poseen simetría esférica en torno al núcleo y se llaman orbitales “s”. Los de valor 1 dan superficies lobuladas, con tres posibles orientaciones y se llaman orbitales “p”. Para l = 2 son orbitales “d” y para el valor 3 son los “f”. CONFIGURACIÓN ELECTRÓNICA Los átomos polielectrónicos presentan dificultades en sus funciones de onda, que deben resolverse con aproximaciones fundamentadas en los espectros. Las interacciones con el núcleo y con los otros electrones hacen que la energía de un orbital no sea la prevista en el átomo de hidrógeno, que solo depende de “n”. Para los demás se usan las reglas siguientes: Proceso Aufbau: la configuración electrónica fundamental se obtiene colocando los e- uno a uno en los orbitales disponibles del átomo en orden creciente de energía.(regla de n+l: el orden creciente de energía para cada orbital es la suma de los dos números y si coinciden tiene menor energía el de menor valor de n). Principio de exclusión de Pauli: en un átomo no puede haber dos electrones con los cuatro números cuánticos idénticos (así que solo habrá dos electrones en cada orbital). Principio de máxima multiplicidad de Hund: siempre que sea posible los electrones tendrán distinto ml e igual spin. Un átomo excitado se corresponde con una configuración que no sigue esas reglas porque alguno de sus e- han saltado a un orbital de más energía pero, generalmente, dentro del mismo nivel (n no cambia), por ejemplo del orbital 2s salta al 2p. Diagrama de Moeller 1 s2 Las anomalías se basan en que los orbitales 2 6 2 s p degenerados semillenos (p3, d5, f7) o llenos (p6, 2 6 10 3 s p d d10, f14) tienen mayor estabilidad. En el Cr un e4 s2 p6 d10 f14 promociona del nivel 4s al 3d para lograr que 5 s2 p6 d10 f14 g18 estos estén semillenos y sea más estable. Cuando 2 6 10 14 18 22 6 s p d f g h los últimos e están en (n-1) d y ns ( o (n-2)f y ns) 7 s2 p6 d10 f14 g18 h22 l26 la estabilidad supera a la ∆E entre los subniveles La configuración de los iones tendrá en cuenta la carga de estos. Si es positiva se debe restar a Z y si es negativa se suma a Z para contar con todos los electrones. ¡CUIDADO!: si el ión es de un metal de transición, los e- perdidos son los s aunque los últimos que se ponen sean los d. La forma de indicarla: el átomo de carbono con Z= 6 Configuración abreviada nxy 1s2 ,2 s2 p2 Diagrama orbital: se suelen representar solamente los e- de valencia, los del último nivel; cada subnivel se representa con una caja, o círculo, y dentro unas flechas para indicar los e- con sus espines, y como tienen que cumplir con Pauli las flechas tendrán sentidos opuestos. Es muy usada para marcar el principio de máxima multiplicidad y para calcular las “valencias” Números cuánticos ( 1,0,0,½ ) ( 1,0,0, -½ ) ( 2,0,0, ½ ) ( 2,0,0,-½ ) ( 2,1,0, ½ ) (2,1,1, ½ ) Configuración simplificada. Los e- se dividen en dos grupos: electrones de valencia (son los de mayor energía, los que ocupan los orbitales más externos y de ellos dependen las propiedades químicas del átomo) y electrones internos (ocupan los orbitales completos , con menor energía). La configuración indica solo los electrones de valencia y, entre corchetes, el gas noble que antecede al elemento. C ( Z = 6) = [He] 2 s2 p2. El sistema periódico - criterio de ordenación: en orden ascendente de número atómico ( nº de protones del núcleo), colocando debajo los que tienen propiedades semejantes. - grupos: 18 columnas. En cada una de ellas todos los elementos tienen la misma configuración electrónica de la capa más externa: capa de valencia, por lo que tienen propiedades químicas semejantes, no iguales, pues varían en intensidad al bajar en el grupo. - periodos: 7 filas horizontales. Los tres primeros, cortos, con 2, 8 y 8 elementos; los dos siguientes medios con 18 elementos y los dos últimos largos con 32 elementos. Cada elemento se diferencia del anterior en 1 protón en el núcleo y 1 e- más en la corteza: electrón diferenciador - clasificación: metales a la izquierda, no metales a la derecha y entre ambos los semimetales o metaloides. Elementos representativos: van completando los subniveles s y p de la última capa. Son los grupos 1,2 y del 13 al 18. Elementos de transición: van completando el subnivel d de la penúltima capa. Del grupo 3 al 12, son los del bloque central. Elementos de transición interna: van completando el subnivel f de la antepenúltima capa. Son los “separados” PROPIEDADES PERIÓDICAS 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 H He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar K Ca Zn Ga Ge Br Kr Rb Sr I Xe La* Cs Ba At Rn Fr Ra Ac** * ** Tamaño: se considera que son esféricos con un radio calculado a partir de los enlaces formados entre átomos de la misma clase. El radio metálico y el covalente es la mitad del enlace. Ambos dan una idea del tamaño de los átomos neutros. Al descender en el grupo, aumentan por hacerlo el número de capas electrónicas y por tanto la distancia al núcleo. A lo largo de un periodo disminuye, pues aumenta el número Z ( protones) que atraen más fuertemente a los electrones; pero tiene mayor tamaño los gases noble (18) que los halógenos (17), y el galio, por ejemplo, un tamaño similar al germanio que debería ser menor: esto es el efecto pantalla de los orbitales d y f, que “tapan” los e- externos de la atracción del núcleo es como si la carga nuclear Z fuese menor. La carga nuclear efectiva es la que determina la fuerza de atracción y es Zef = Z – σ . A lo largo de un periodo crece la carga nuclear Z y la Zef también pero menos, pues crece el efecto pantalla σ. A lo largo de un grupo el efecto pantalla crece de manera similar a como lo hace Z por lo que la efectiva no cambia. En cuanto a los iones el radio del catión (+) es siempre menor que el del átomo neutro, mientras que el anión (-) es siempre mayor. Para iones isoelectrónicos ( igual nº de e-) dentro de un periodo tanto los radios iónicos disminuyen al aumentar Z, porque la fuerza de atracción del núcleo sobre el e- más externo será mayor al tener más protones; así entre F-, O2, Na+ tendrá menor tamaño el ión sodio. Y aumenta a medida que lo hace la carga – por aumentar la repulsión entre los e- . Dentro de un grupo aumenta el tamaño al hacerlo la distancia al núcleo igual que los radios atómicos. Energía de ionización: o potencial de ionización es la E. mínima necesaria para arrancar 1 eal átomo gaseoso en su estado fundamental, transformándolo en ión positivo. Es una magnitud endotérmica: en un mismo grupo disminuyen al bajar, mayor radio y más débilmente atraídos; en un periodo aumenta al avanzar por él pues disminuye el radio y están más atraídos por el núcleo. Está íntimamente relacionada con el radio, a medida que estos disminuyen aumenta la energía necesaria para arrancar el electrón. Existen las energías de ionización sucesivas que son las necesarias para ir quitando el 2º, 3º, 4º,… e del átomo (son cada vez mayores, puesto que hay exceso de carga + en el núcleo; es espectacular en el caso de que el e- esté en un nivel inferior: el Mg ( 3s2 ) tiene las dos primeras “normales” pero la tercera es cientos de veces mayor que la 1ª. Hay una anomalía entre los elementos del grupo del Be, alcalinotérreos, y los del B. La de estos últimos deberá ser mayor y no es así; pierden su e- situado en el “p” y quedan con s lo que les da estabilidad, la energía es menor. Tiene que ver con el carácter metálico, cuanto menor es la energía de ionización más metálico es el elemento. Afinidad electrónica la energía intercambiada cuando un átomo gaseoso en su estado fundamental incorpora 1 e- libre transformándose en un ión -. Es positiva o negativa: los halógenos las tienen muy negativas pues un e- mas les da la configuración de gas noble; éstos, por el contrario tienen afinidades altas y positivas. Con subniveles completos (Be) o semillenos (N) tienen valores negativos menores, o positivos. En valor absoluto, su variación es como la de la energía de ionización. También existen afinidades sucesivas. Al formarse el anión A- aumenta el número de electrones y con ello, aumenta la constante de apantallamiento y disminuye la carga nuclear efectiva, lo que hace que la fuerza de atracción del núcleo sobre el electrón más externo sea menor. Electronegatividad es la tendencia que tiene un elemento para atraer hacia sí el par electrónico del enlace compartido con otro. Su valor está relacionado con los dos anteriores y su variación es similar a la de estos. No puede medirse directamente. Hay unas tablas comparativas, en la de Pauling el flúor es el más electronegativo y el cesio el menor. La electronegatividad de un elemento es mayor cuanto menor es su radio atómico y cuanto mayor es su carga nuclear efectiva. Por tanto, la electronegatividad de un átomo aumenta en un: ‐ Grupo al disminuir el valor del número cuántico principal n. ‐ Periodo al aumentar el valor del número atómico. La disminución va así: F, O, Cl = N, Br, S = C = I, Se, P, H. Carácter metálico : opuesto a la electronegatividad. El comportamiento metálico de un elemento disminuye conforme se avanza en un periodo, ya que se va poblando de electrones el nivel y con ello se pierde la capacidad de ceder electrones (oxidarse) característica de los metales. El carácter metálico de un elemento está relacionado con su facilidad para perder electrones y formar cationes. El carácter oxidante de los elementos de un mismo grupo decrece al aumentar el número atómico ya que a pesar de tener la misma carga nuclear efectiva la atracción del núcleo para incorporar electrones y reducirse disminuye la aumentar el tamaño de los átomos. Número de oxidación: es el nº de e- ganados (-) o perdidos (+) por un átomo cuando forma un compuesto químico. En un grupo tienen los mismos nº de oxidación más representativos; así los alcalinos tiene +1 y los halógenos el -1. Ejercicios 1.- Completa la tabla A Z Número e 31 15 15 Número p 15 11 Número n 16 12 símbolo 31 15P 16 46 47 especie Átomo neutro Ión (1+) 28O 61 14 8 2.-Calcula la masa atómica del argón sabiendo que las 35’968 u 0’337% masas isotópicas y las abundancias relativas de sus tres 37’963 u 0’063% isótopos son las indicadas en la tabla. 39’962 u 99’6% (39’947) 3.- El litio masa atómica 6’941 u posee dos isótopos naturales, el litio-6 y el litio-7, de masas 6’01513 y 7’01601 u respectivamente.¿Cuál es la abundancia relativa de cada isótopo?( 7’49) 4.- Deduce los posibles números cuánticos para 1 e- que ocupa un orbital 5p. (6 con) 5.- ¿Son posibles las siguientes combinaciones cuánticas? ¿A quién representan? b) 2,1,-1 d) 4, 3, -3 e) 1,0,0,0 a) 1,1,0, - ½ c) 2,3,0,½ 6.- ¿Cuáles son las configuraciones de los gases nobles?. 7.- Escribe las configuraciones electrónicas abreviadas y simplificadas de los elementos: sodio, calcio, indio, silicio, bismuto, selenio y yodo. 8.- Escribe las configuraciones electrónicas abreviadas y simplificadas de los elementos e iones: a) Cr ; b) Cu ; c) Ag ; d) K+ ; e) Fe3+ ; f) Cl- ; g) As3- . 9.- Utilizando la regla n+l ordena de menor a mayor energía los subniveles 3p, 3d, 4s, 4p, 4 f, 5s. 10.- Si un elemento tiene de Z = 35 indica los números cuánticos de su electrón diferenciador. 11.- Justifica/explica las siguientes configuraciones electrónicas: a) 1s2 2s2 p6 3s1 b) 1s2 2s2 p6 3s0p1 c) 1s2 2s2 p5 3s2 d) 1s2 2s2 p5 3s1p1 12.- Dados los elementos de nº atómico 10, 16 y 19, ordénalos en forma creciente de sus tamaños y electronegatividades. 13.- Para los anteriores elementos a) ¿ qué iones darán? ; b) ¿cómo será el tamaño de éstos respecto al de su átomo? ¿ sigue manteniéndose el orden de tamaño? 14.- Identifica las siguientes configuraciones con los elementos correspondientes y razona los estados de oxidación más probables para ellos: 1s2 2 s2 p3 1s2 2 s2 p6 3 s2 p5 1s2 2 s2 p2 1s2 2 s2 p4 15.- Dados los elementos silicio, cloro, estaño y flúor, ordénalos de forma creciente según: a) sus radios atómicos; b) su primer potencial de ionización. ( F,Cl,Si,Sn ; Sn, Si,Cl,F) 16.- Ordena en forma creciente de tamaños los iones: F- , N3-, O2- , Li+ y Be2+ . (Be,Li,F,O,N) 17.- ¿Cómo serán los tamaños del protón y del hidruro respecto al del hidrógeno?. 18.- Los números atómicos de tres elementos A, B y C son (Z-1), Z y (Z+1). El B es un gas nobles y está en el periodo 3º y: a) ¿en qué grupo están el A y el C? ¿cuál de ellos presenta una E. de ionización mayor?; b) ¿en qué periodo están? ¿quién tiene un radio mayor?