Evolución de Proteínas
Anuncio

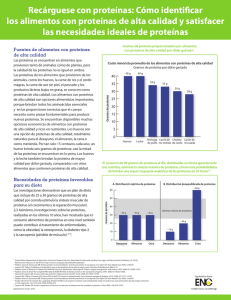
Bioquímica de Macromoléculas Ana Claudia Flores EVOLUCIÓN CONVERGENTE Y DIVERGENTE DE PROTEÍNAS 1 Bioquímica de Macromoléculas EVOLUCIÓN CONVERGENTE Y DIVERGENTE DE PROTEÍNAS Cuando dos especies divergen a partir de una se da lugar al surgimiento de un nuevo linaje. Se establecen, a partir de ese momento, dos versiones de una misma proteína. Las mutaciones ocurren al azar en los genes codificantes de cada versión y una vez que esta mutación se fija por drift genético o selección natural la secuencia de aminoácidos comienza a cambiar lentamente en forma independiente de lo que ocurre con el gen homólogo en la otra especie. La “desconexión” de dos genes para una misma proteína puede ocurrir en un mismo organismo por duplicación génica como resultado de un error en el proceso de replicación. A raíz de esta separación la secuencia de ambas proteínas es capaz de variar independientemente. Como resultado, aparecen isoformas que pueden especializarse y responder demandas separadas. Estas demandas son a menudo establecidas en tejidos individuales en el organismo y las dos secuencias divergen satisfaciendo estos requerimientos particulares. (1) Podemos decir entonces que la historia de la proteína está contenida en su secuencia de aa y puede ser reconstruida por comparación de la misma en especies diferentes. Como la secuencia cambia mucho más rápido que la estructura tridimensional, al intentar estudiar proteínas relacionadas distantemente es necesario complementar el alineamiento de secuencia con la superposición de modelos moleculares cristalográficos. Es a partir de estas comparaciones que pueden elucidarse los gaps que aparecen en el alineamiento e incluso pueden relacionarse proteínas con escasa similitud de secuencia. El análisis de estas relaciones permite inferir el origen de determinadas estructuras o establecer nuevas estructuras. Para decidir si un dominio presenta un nuevo plegamiento o está relacionado distantemente con otra proteína es útil centrar la atención en “detalles finos”, es decir, buscar similitudes de empaquetamiento raras o inusuales que permitan suponer que es poco probable que puedan haber aparecido en forma independiente y su similitud ser casual. En base a esto, 2 Bioquímica de Macromoléculas estudios recientes determinaron la relación del dominio catalítico de la adenil ciclasa con el dominio “ palm” de la DNA polimerasa I (dos estructuras superponibles pero con escasa similitud de secuencia). En ambas hay varias características conservadas ausentes en proteínas con el mismo motivo estructural. Ambas proteínas catalizan reacciones distintas pero análogas, divergencia funcional típica de proteínas relacionadas distantemente. (2) La frecuencia con la cual los residuos cambian en distintas posiciones es desigual. Es mayor en la superficie y en los loops que conectan estructuras secundarias que en las posiciones más internas en el empaquetamiento. Este comportamiento de selección natural refleja severas restricciones de variación. Si bien las proteínas que han divergido aún retienen la arquitectura y topología de su plegamiento ancestral, el plegamiento puede cambiar durante la evolución. Pueden existir distintos topoisómeros en los cuáles los elementos de estructura secundaria son los mismos pero alguno de los loops conectores están arreglados de manera diferente. Como la contribución a la energía libre del estado plegado es pequeña, la estabilidad de los topoisómeros puede ser similar. La conversión de uno a otro requiere de un unfolding parcial lo que establece una barrera termodinámica y cinética a la topoisomerización espontánea. Estos isómeros de plegado nativo son entonces “trampas cinéticas” o estados metaestables en el proceso de plegamiento.(2) Las globinas son una familia de proteínas para las cuales muchas secuencias están disponibles, han surgido muy tempranamente en la evolución y están presentes en una variedad de organismos, desde bacterias hasta el hombre. Dentro de las hemoglobinas (Hb), la de peces ha divergido más que la de los animales de respiración aérea. Por superposición de las estructuras de Hb humana y de raya se ha visto que la estructura cuaternaria es altamente conservada entre los vertebrados pero existen numerosas diferencias en los aa implicados en el sitio de captura de O2.(1,3) 3 Bioquímica de Macromoléculas Muchas veces dos proteínas pueden presentar una estructura homóloga sin haber tenido un ancestro común. Esto es, pueden llegar a solucionar un mecanismo particular con una estructura similar por evolución convergente. La estructura ClpP (componente proteolítico de la proteasa Clp) es un ejemplo de este tipo de evolución. En su estructura cuaternaria comparte la arquitectura de barril similar a otras proteasas ATP-dependientes. En el sitio activo se encuentra la tríada catalítica presente en la quimotripsina y otras tres superfamilias de serin proteasas. A pesar de estas similitudes el plegamiento de la subunidad de ClpP no muestra relación con ninguna proteasa de estructura conocida.(2) Varias son las estructuras que se han analizado y el número aumenta a diario. Y con este aumento surgen también nuevos métodos de estudio para optimizar los ya existentes. Los modelos probabilísticos que se arman para los estudios de evolución por apilamiento de secuencia se basan en la construcción de matrices de reemplazo para establecer las comparaciones. Se asume que todos los sitios en una proteína evolucionan independientemente unos de otros y con la misma probabilidad. Pero esto es una limitación en el estudio por lo que se están incorporando variaciones de sitios de residuos “preferidos” e incluso definiendo categorías entre los sitios acordes con atributos fisicoquímicos (aa periféricos, hidrofobicidad, etc).(4,5) Otros métodos apuntan a investigar el uso de comparación de la estructura secundaria para discriminar entre proteínas relacionadas y no relacionadas. Estos pueden proveer información para la detección de proteínas relacionadas tridimensionalmente con escasa similitud de secuencia (entre 10%-30%).(6) Y mientras intentamos aproximar y descubrir la forma en que la naturaleza sabiamente ha actuado nos sorprendemos a cada paso. Muchos son los interrogantes que se plantean y que quedan por responder para tratar de establecer las relaciones entre secuencia y estructura y entre estructura y función. A partir de este entendimiento se anhela poder llegar a hacer predicciones a partir de sólo la secuencia de una proteína desconocida, pero esta ya es otra historia... 4 Bioquímica de Macromoléculas Referencias 1. Kyte, JacK. Structure in Protein Chemistry. Garland Publishing, New York & London, 1995, 243-274. 2. Murzin, Alexey G. How far divergent evolution goes in proteins. Current Opinion in Structural Biology 1998, 8: 380-387. 3. Yukie Naoi, Khoon Tee Chong, Kazuhiko Yoshimatsu, Gentaro Miyazaki, Jeremy R. H. Tame, Sam-Yong Park, Shin-ichi Adachi y Hideki Morimoto. The functional similarity and structural diversity of human and cartilaginous fish hemoglobins. J. Mol. Biol 2001, 307, 259-270. 4. Thorne, Jeffrey L. Models of protein sequence evolution and their applications. Current Opinion in Genetics & Development 2000, 10:602-605. 5. Chang, Belinda S.W. y Donoghue, Michael J. Recreating ancestral proteins. Tree 2000, 15: 109-114. 6. Geourjon, Combet, Blanchet y Deléage Gilbert. Identification of related proteins with werak sequence identity using secondary structure information. Protein Science 2001, 10: 788-797. 7. Branden, Carl, Tooze, John. Introdution to Protein Structure. Garland Publishing, USA 1991, 48, 238. 5