Presion de vapor
Anuncio
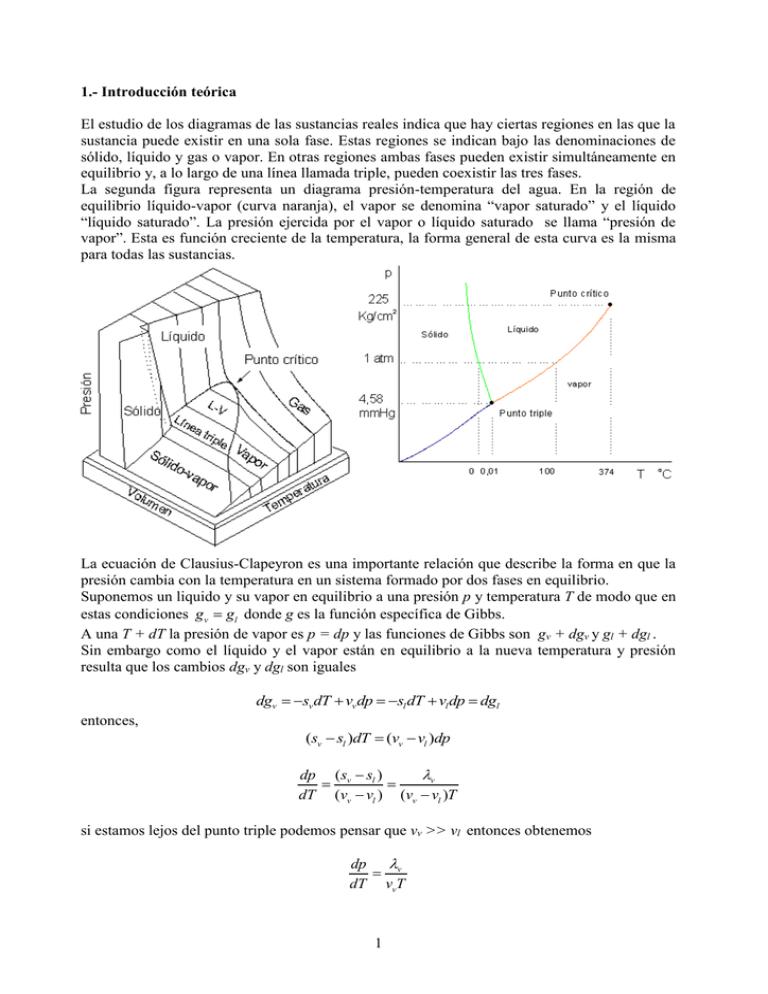
1.- Introducción teórica El estudio de los diagramas de las sustancias reales indica que hay ciertas regiones en las que la sustancia puede existir en una sola fase. Estas regiones se indican bajo las denominaciones de sólido, líquido y gas o vapor. En otras regiones ambas fases pueden existir simultáneamente en equilibrio y, a lo largo de una línea llamada triple, pueden coexistir las tres fases. La segunda figura representa un diagrama presión-temperatura del agua. En la región de equilibrio líquido-vapor (curva naranja), el vapor se denomina “vapor saturado” y el líquido “líquido saturado”. La presión ejercida por el vapor o líquido saturado se llama “presión de vapor”. Esta es función creciente de la temperatura, la forma general de esta curva es la misma para todas las sustancias. La ecuación de Clausius-Clapeyron es una importante relación que describe la forma en que la presión cambia con la temperatura en un sistema formado por dos fases en equilibrio. Suponemos un liquido y su vapor en equilibrio a una presión p y temperatura T de modo que en estas condiciones gv gl donde g es la función específica de Gibbs. A una T + dT la presión de vapor es p = dp y las funciones de Gibbs son gv + dgv y gl + dgl . Sin embargo como el líquido y el vapor están en equilibrio a la nueva temperatura y presión resulta que los cambios dgv y dgl son iguales dgv sv dT vv dp sl dT vl dp dgl entonces, (sv sl )dT (vv vl )dp v dp ( sv sl ) dT (vv vl ) (vv vl )T si estamos lejos del punto triple podemos pensar que vv >> vl entonces obtenemos dp v dT vvT 1 y utilizando la ecuación del gas ideal v dp dp ## ## v 2 dT dT RT T p RT p 2.- Objetivos experimentales o Obtener la curva de equilibrio de las fases líquido-vapor para el agua en las variables presión temeperatura, es decir, medir la presión de vapor para distintas temperaturas. En base a estos datos y utilizando la ecuación de Clausius-Clapeyron calcular el calor latente de vaporización. o Calcular el calor latente de vaporización a presión atmosférica mediante un método más directo que el anterior. 3.- Desarrollo Experimental El práctico se divide en dos partes. Primera parte: Elementos utilizados Recipiente Botellón Condensador Liebig Trampa de agua Manómetro Termocupla con su correspondiente visor Válvulas y mangueras Mechero Bunsen Regla calibrada Sellador En la figura se puede ver un esquema del dispositivo utilizado. 2 En este equipo se practicó vacío mediante la trampa de agua que se conecta a la canilla de la red. El botellón sirve como reserva de vacío y para que, si bajase la presión de la red no se contamine el recipiente con agua de la canilla. El recipiente se llenó con agua destilada hasta un poco mas da la mitad, además se le colocó una piedrita que jugaba el papel de núcleo de vaporización. A la salida del recipiente se 0colocó un condensador Liebig cuya función era evitar que el agua evaporada aumente la presión del sistema, haciéndola regresar al recipiente. Antes que nada se trato de reducir al máximo las perdidas de vacío del sistema, sellándolo con Fastix y silicona con la trampa de agua conectada. Así el sellador ingresaba por los orificios obteniendo un mejor sellado. Se comienza el experimento bajando lo más posible la presión y se cierra la válvula A. Con el mechero Bunsen se calienta el agua del recipiente hasta que alcanza el cambio de fase. En este momento se registran los valores de presión y temperatura mediante el manómetro y la termocupla. Abriendo un poco la válvula C se dejaba entrar aire para aumentar la presión del sistema y nuevamente se esperaba la temperatura de cambio de fase. Segunda Parte: Elementos utilizados Recipiente calibrado Termo Condensador Liebig Resistencia calefactora de 60 Resistencia variable de 300 Amperímetro Voltímetro Cronómetro En la figura se puede ver un esquema del dispositivo utilizado. Se llenó el termo con agua destilada y se colocó una resistencia (calentador) conectada a un circuito que nos permitía medir y regular la potencia entregada a la misma. El termo estaba sellado y se lo conectó a un condensador el cual goteaba en un recipiente calibrado (de 5 a 25 ml). En un principio se construyó un condensador con una serpentina de cobre para así obtener 3 un mayor intercambio de calor. Pero dada la geometría de esta no se logró obtener un caudal uniforme y constante, por lo que se decidió utilizar el clásico condensador Liebig. El agua se calentaba con la resistencia hasta su evaporación, luego se condensaba y goteaba en el recipiente. Regulando la potencia entregada se buscaba producir un régimen de caudal constante. Acto seguido se colocaba el recipiente calibrado vacío y mientras este se llenaba se registraba el tiempo transcurrido y la masa depositada en distintos instantes. Vale aclarar que la magnitud medida era el volumen en ml y se tomó la densidad del agua igual a 1 gr/ml. 5.- Cálculos Primera Parte: A la diferencia de presión medida en el manómetro le sumamos la presión atmosférica, que fue obtenida del barómetro de Torricelli. Recordando la ecuación de Clausius-Clapeyron para un cambio de fase líquido-vapor dp v 2 dT p RT [1] integrando, y teniendo en cuenta que en este rango de temperaturas podemos considerar v constante, obtenemos ln p v C [2] RT por lo tanto graficando ln p en función de 1/T obtendremos una recta con pendiente -v/R y de aquí despejamos v. Con los datos obtenidos graficamos la presión de vapor en el plano termodinámico p-T. Teóricamente, utilizando la ecuación anterior, obtenemos que la curva es de la forma p p0e v RT [3] donde p0 es una condición de contorno que podemos deducir en base a datos obtenidos experimentalmente, a la presión atmosférica del día de las mediciones, de la siguiente forma v p0 pe RT donde p = (102658 400) Pa , v/R = (4843 9) ºK y T = (373,9 1,7) °K y queda p0 = (4,33 0,38 ) · 1010 Pa Segunda Parte: Para evaluar las pérdidas que se presentan en este experimento proponemos que las mismas son proporcionales al tiempo transcurrido El balance energético medido es Pt Q q [4] donde P es la potencia eléctrica suministrada, t es el tiempo transcurrido Q es el calor necesario para vaporizar una masa m de agua y q es el calor perdido durante el proceso. Como supusimos que q es proporcional al tiempo y dado que Q =vm resulta 4 Pt v m ct ## ## m Pc v t [5] Se pueden observar en el anexo las gráficas de esta función para distintos valores de P. En ellas se ve claramente la dependencia lineal de la masa evaporada en función del tiempo, lo que sustenta el modelo supuesto para las pérdidas. Luego con los valores de las pendientes de estas rectas se obtiene el siguiente sistema de ecuaciones que permite obtener c y v, P1 c B1 v P2 c B 2 v donde B1 y B2 son las pendientes despejando obtenemos v P2 P1 PB P B [6] y c 1 2 2 1 [7] B2 B1 B2 B1 6.- Tablas y Gráficas Primera Parte: Presión atmosférica medida el día de las mediciones: (770 1) mm Hg Presión Error [mm Hg] [mm Hg] 315 3 325 3 338 3 345 3 354 3 366 3 373 3 385 3 394 3 407 3 421 3 431 3 443 3 453 3 463 3 471 3 482 3 491 3 503 3 514 3 524 3 536 3 549 3 560 3 570 3 582 3 Presión [Pa] 41997 43330 45063 45996 47196 48796 49729 51329 52529 54262 56129 57462 59062 60395 61728 62795 64261 65461 67061 68528 69861 71461 73194 74661 75994 77594 Error [Pa] 400 400 400 400 400 400 400 400 400 400 400 400 400 400 400 400 400 400 400 400 400 400 400 400 400 400 5 Temp [°C] 77 77,7 78,6 79,1 79,8 80,7 81,3 82,1 82,6 83,3 84,3 85,1 85,7 86,2 86,8 87,4 88,1 88,6 89,2 89,8 90,3 90,9 91,5 92,2 92,6 93,1 Error [°C] 1,7 1,7 1,7 1,7 1,7 1,7 1,7 1,7 1,7 1,7 1,7 1,7 1,7 1,7 1,7 1,7 1,7 1,7 1,7 1,7 1,7 1,7 1,7 1,7 1,7 1,7 593 605 619 631 645 660 671 704 716 729 737 748 758 770 3 3 3 3 3 3 3 3 3 3 3 3 3 3 79060 80660 82527 84126 85993 87993 89459 93859 95459 97192 98259 99725 101058 102658 400 400 400 400 400 400 400 400 400 400 400 400 400 400 93,7 94,1 94,7 95,4 96 96,6 97,1 98,5 99 99,5 99,7 100,1 100,7 100,9 1,7 1,7 1,7 1,7 1,7 1,7 1,7 1,7 1,7 1,7 1,7 1,7 1,7 1,7 En el anexo se adjuntó una tabla igual a la anterior pero con datos obtenidos de libro. Gráfica 1 – Ln(p) vs. 1/T, la pendiente de esta gráfica es v , siendo R la constante universal de los gases R El valor de la pendiente es (- 4843 9) ºK, con esto obtenemos los siguientes valores: v 40264 80 2235 5 [J/mol] [J/gr] 6 110000 100000 Presión [Pa] 90000 80000 70000 60000 50000 40000 350 355 360 365 370 375 Temperatura [°K] Gráfica 2 – P vs. T para puntos de equilibrio de fases Líquido-Vapor del agua 110000 100000 Presión [Pa] 90000 80000 70000 60000 50000 Valores Experimentales Valores Teóricos 40000 350 355 360 365 370 375 Temperatura [°K] Gráfica 3 – Comparación de P vs. T de la función obtenida teóricamente (ecuación [3]) con los valores tomados experimentalmente Segunda Parte: Los siguientes son los valores de las pendientes obtenidos mediante regresión de la ecuación [5] para distintas mediciones (las tablas y gráficas de las mediciones se encuentran en el anexo). 7 Medición 1 2 3 4 Potencia [W] 60,0 0,1 75,5 0,1 60,0 0,1 76,2 0,1 Pendiente [gr/s] 0,02381 7 ·10-5 0,03061 10 ·10-5 0,02375 6 ·10-5 0,03085 30 ·10-5 Combinando estos valores armamos los sistemas de ecuaciones [6] y [7] y obtenemos: v [J/gr] c [J/s] 2257 100 2276 100 2276 100 2295 100 6,4 1,5 5,8 1,5 5,9 1,5 5,3 1,5 Vale aclarar que deberíamos obtener seis valores de v haciendo todas las combinaciones posibles, pero para que los sistemas de ecuaciones tengan sentido no podemos combinar mediciones hechas con potencias similares, caso de 1 con 3 y 2 con 4. El valor de v obtenido de libro es 2257 [J/gr] 7.- Conclusión Podemos ver que el método experimental para obtener la presión de vapor es muy efectivo, ya que los valores tomados de presión y temperatura coinciden notablemente con los de la curva obtenida mediante la ecuación de Clausius-Clapeyron y son muy parecidos a los obtenidos de libro. Hay que recordar que en los intervalos de presión y temperatura en los que trabajamos la aproximación utilizada sobre la ecuación de Clausius-Clapeyron de despreciar el volumen específico del líquido respecto del vapor es muy buena. En cuanto al cálculo de v podemos concluir que ambos experimentos nos dieron resultados bastante satisfactorios comparándolos con los obtenidos de libro. Con lo respectivo al armado del experimento podemos comentar el aumento de experiencia en técnicas de sellado, armado de circuitos eléctricos y conexión de mangueras y válvulas. 8.- Bibliografía ¨ Experimentos De Fisicoquímica ¨ - Urquiza ¨ Trabajos Prácticos De Física ¨ - Fernández Galloni ¨ Fisicoquímica Experimental ¨ – Daniels ¨ Handbook Of Chemistry And Physics ¨ 8
