BLOQUE I: UNIONES QUÍMICAS. 1.- TIPOS DE UNIONES: INTERMOLECULARES E INTRAMOLECULAREs.
Anuncio
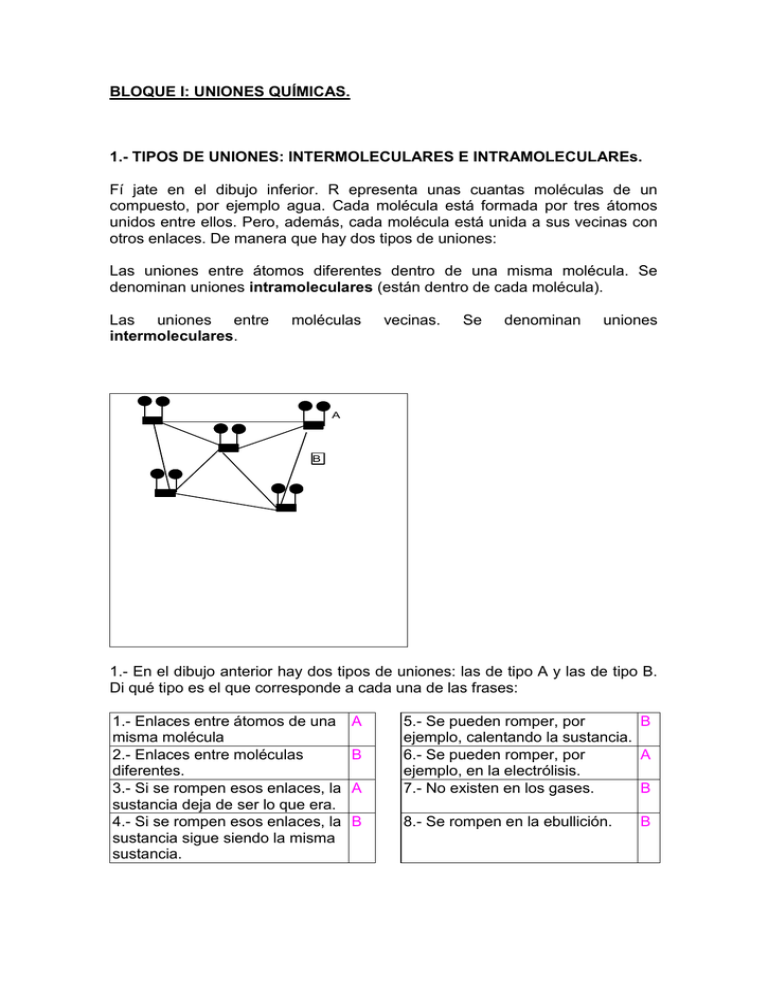
BLOQUE I: UNIONES QUÍMICAS. 1.- TIPOS DE UNIONES: INTERMOLECULARES E INTRAMOLECULAREs. Fí jate en el dibujo inferior. R epresenta unas cuantas moléculas de un compuesto, por ejemplo agua. Cada molécula está formada por tres átomos unidos entre ellos. Pero, además, cada molécula está unida a sus vecinas con otros enlaces. De manera que hay dos tipos de uniones: Las uniones entre átomos diferentes dentro de una misma molécula. Se denominan uniones intramoleculares (están dentro de cada molécula). Las uniones entre intermoleculares. moléculas vecinas. Se denominan uniones A B 1.- En el dibujo anterior hay dos tipos de uniones: las de tipo A y las de tipo B. Di qué tipo es el que corresponde a cada una de las frases: 1.- Enlaces entre átomos de una misma molécula 2.- Enlaces entre moléculas diferentes. 3.- Si se rompen esos enlaces, la sustancia deja de ser lo que era. 4.- Si se rompen esos enlaces, la sustancia sigue siendo la misma sustancia. A A 5.- Se pueden romper, por B ejemplo, calentando la sustancia. 6.- Se pueden romper, por A ejemplo, en la electrólisis. 7.- No existen en los gases. B B 8.- Se rompen en la ebullición. B B 2.- Completa las siguientes frases colocando "intramoleculares" o "intermoleculares" según corresponda: a.- Los enlaces .Intramoleculares.. son los responsables de las uniones entre átomos dentro de una misma molécula. b.- Si los enlaces .Intermoleculares.. son muy fuertes, será muy difícil romper la molécula en sus átomos constituyentes. c.- Si los enlaces ..Intermoleculares.. son muy débiles será muy fácil pasar la sustancia de sólido a líquido. d.- Ya viste que el éter pasa a vapor a temperaturas más bajas que el agua. Por eso puede decirse que los enlaces . Intermoleculares. del éter son más ..débiles. que los del agua. e.- En la pág. 40 del libro aparecen los puntos de fusión y de ebullición de la sal (801 ºC y 1413 º). Son bastante más altos que los correspondientes puntos del agua y también más altos que el del azúcar (180º). Por ello podrá afirmarse que los enlaces ..Intermoleculares.. de la sal son más ..fuertes.. que los correspondientes enlaces . Intermoleculares del azúcar. f.- Las uniones entre dos átomos de distintos elementos para formar un compuesto se llaman enlaces .Intramoleculares. 3.- Ya sabes que la fórmula del metano es así: CH4. H H C H H H H C H H a.- Los enlaces entre un átomo de C y un átomo de H dentro de una molécula son del tipo _Intramolecualres__. b.- Los enlaces entre dos moléculas diferentes de metano son del tipo Intermoleculares. c.- El punto de ebullición del metano es -160ºC. Eso quiere decir que a temperatura ambiente (unos 20 ºC) no existe alguno de los enlaces dibujados. ¿Cuál? El intermolecular 2.- Regla del octete. Acabas de ver con algún detalle algo queya sabias: Los átomos que constituyen una molécula están unidos entre ellos. Las uniones entre los átomos que constituyen una molécula se denominan enlaces intramoleculares. ¿Cómo son esas uniones? Vamos a verlo en esta sección. Primeramente has de saber que, en primera aproximación , todos los átomos tienen tendencia a tener 8 (ocho) electrones en su última capa (a no ser que la últiam capa sea la capa 1 en cuyo caso no podrá haber 8 electrones puesto que solamente caben 2). Esta regla se conoce como regla del octete. Más adelante verás que tiene muchas excepciones (átomos que "se conforman" con un número diferente de 8 electrones). ¿Recuerdas dónde estaban situados los gases nobles? Todos ellos tienen 8 electrones en su última capa. Por eso, los gases nobles (He, Ne, Ar, Kr, Xe, Rn) no necesitan unirse con ningún otro átomo para conseguir su octete. Por ello es muy difícil obtener compuestos de alguno de los gases nobles. 4.- En qué grupo de la tabla periódica están alojados los elementos más estables? 5.- Los elementos más estables se caracterizan por que no forman uniones Intramoleculares. con los átomos de ningún otro elemento. 6.- Aquí te pongo los números atómicos de algunos de los elementos estables. Escribe al lado sus configuraciones electrónicas: He Ne Ar Kr Xe 2 10 18 36 54 2 2,8 2,8,8 2,8,18,8 2,8,18,18,8 . Hay alguna característica común a casi todas las configuraciones? Enúnciala: Todos los elementos del grupo ..18 (halógenos).. tienen ...8.... electrones en su última capa, menos el ..He...... que solamente tiene ....2.... por que no le caben más. 7.- ¿Qué pueden hacer los siguientes elementos para alcanzar estructura electrónica de gas noble? Na Cl H Ca F C O Mg Al S Z 11 17 1 20 9 6 8 12 13 16 Configuración electrónica 2,8,1 2,8,7 1 2,8,8,2 2,7 2,4 2,6 2,8,2 2,8,3 2,8,6 PERDER ELEC. 1 7 1 2 7 4 6 2 3 6 GANAR ELECT. 7 1 1 6 1 4 2 6 5 2 LO MÁS PROBABLE Perder 1 Ganar 1 Perder 1 Perder 2 Ganar 1 Perder/Ganar 4 Ganar 2 Perder 2 Perder 5 Ganar 2 8.- Si un átomo gana electrones, acabará teniendo un número de protones .menor que de electrones, y por eso se dirá que es un ión negativo (anión) 9.- Si un átomo pierde electrones, acabará teniendo un número de protones mayor que de electrones, y por eso se dirá que es un ión positivo (catión) Formación de los enlaces iónicos. F Z=9 Mg Z=12 F Z=9 Imagínate que un recipiente se introduce un poco de flúor (Z = 9) y otro poco de magnesio (Z = 12). Las configuraciones electrónicas de los átomos de cada uno de esos elementos son así: F : 2-7 Mg: 2-8-2 Qué tenderá a hacer cada uno de los átomos de F y de Ca para alcanzar estructura electrónica estable? Los átomos de F tienen necesidad de ganar 1 electrón. Los átomos de Mg tienen necesidad de perder 2 electrones. Para armonizar esas tendencias, cada átomo de Mg transferirá 2 electrones a dos átomos de F, de modo que cada átomo de Mg quedará con dos cargas positivas y cada átomo de F quedará con una carga negativa: F + 1e- --> FMg - 2 e- --> Mg2+ F + 1e- --> FDe ese modo, los átomos de F se convertirán en iones negativos también denominados aniones. Los átomos de Mg se convertirán en iones positivos también denominados cationes. Las ecuaciones de formación de los iones son: Mg - 2e- --> Mg2+ F + 1 e- --> FPero para equilibrar el número de leectornes que pierde al átomo perdedor con los leectrnes que ganan los átomos ganadores, es evidente que habrá que multiplicar por 2 la ecuación de abajo: Mg - 2e- --> Mg2+ 2F + 2 e- --> 2F- Después de la transferencia de los electrones sucederá que entre los iones positivos y negativos que se han formado surgirán atracciones electrostáticas. Esas fuerzas atractivas serán el enlace iónico: entre iones de distinta carga eléctrica. Finalmente, en el compuesto resultante sucederá que por cada 1 átomo (mejor, catión) de Mg2+, habrá 2 átomos (mejor, aniones) de F-. Podrá decirse que la fórmula molecular del fluoruro cálcico será así: MgF2. Ya ves que en cada molécula hay dos átomos (mejor dicho, dos iones) de flúor y un átomo (mejor dicho, un ión) de magnesio. Cada átomo de F pesa 19 umas y cada átomo de Mg pesa 40 umas. Son los pesos atómicos. Aunque los iones tengan algún electrón de más o de menos, sus pesos seguirán siendo los mismos: Has de recordar que la masa de los electrones es despreciable. Por eso se podrá decir que en el fluoruro cálcico sucede que ... Frase I: En cada 62 umas de fluoruro de magnesio magnesio y 38 umas de fluor. hay 24 umas de Frase II: Por cada 62 gramos de fluoruro de magnesio hay 24 gramos de magnesio y 38 gramos de fluor. Mg F2 24 38 62 10.- Realiza el mismo proceso para averiguar la composición del compuesto que se forman cuando se unen el oxígeno con el aluminio. Para ello: a.- Consulta sus números atómicos. b.- Escribe sus configuracioes electrónicas. c.- Escribe las ecuaciones de ganancia/pérdida de electrones. d.- Busca la fórmula del compuesto resultante. Al2O3 e.- Haz los cálculos necesarios. 11.- Calcula cuántos gramos de aluminio y cuántos de oxígeno hay en 763 gramos de óxido de aluminio. (403,94 g de Al; 359,05 g de O) 4.- Las uniones entre moléculas diferentes en los compuestos iónicos: El cloruro sódico es una sustancia muy parecida al fluoruro de magnesio. Cuando se juntan cloro y sodio, cada átomo de cloro arrebata un electrón a cada átomo de sodio, formándose iones Cl- (aniones) y iones Na+ (cationes). El dibujo inferior representa unas cuantas moléculas de cloruro sódico. En él se han representado los iones Cl- y los iones Na+. Observa que no hay ninguna diferencia entre las uniones intermolecualres y las uniones intramoleculares. En ambos casos se trata de atracciones electrostáticas idénticas. + - + - - + - + + - + - 12.- En los compuestos iónicos ¿son más fuertes los enlaces intramoleculares o los intermoleculares? Son iguales. 13.- ¿A qué son debidas las uniones entre moléculas vecinas en una sustancia iónica? Atracciones electrostáticas entre iones de signos contrario. El enlace iónico solo se puede formar en algunos casos. En otros casos no es posible. 14.- La condición imprescindible para que pueda formarse un enlace iónico es que (v/f): a.- Todos los átomos que se van a unir tengan tendencia a dar electrones. F b.- Todos los átomos que se van a unir tengan tendencia a coger electrones. F c.- Unos de los átomos tengan tendencia a dar electrones y otros a coger electrones. V d.- Todos los dos átomos tengan tendencia a convertirse en aniones. F e.- Todos los dos átomos tengan tendencia a convertirse en cationes. F 15.- Ten en cuenta que: 1.- Cada átomo de sodio tiene tendencia a ceder un electrón. 2.- Cada átomo de potasio tiene tendencia a ceder un electrón. 3.- Cada átomo de cloro tiene tendencia a arrebatar un electrón. Di en cuáles de los siguientes casos será posible la formación de enlaces iónicos: a.- Entre dos átomos de sodio. No b.- Entre dos átomos de cloro. No c.- Entre átomos de sodio y átomos de potasio. No d.- Entre átomos de cloro y átomos de potasio. Sí e.- Entre dos átomos de potasio. No Hay átomos que no pueden alcanzar su octete a través de enlaces iónicos. Pero sí pueden hacerlo a través de otros tipos de enlaces. El enlace covalente Imágínate un recipiente que contenga solamente átomos de fluor. Su configuración electrónica es 2-7. Observa cuál es el procedimiento que siguen esos átomos para conseguir su octete: B A Cada átomo de F tiene en su última capa 7 electrones y un hueco. Dos átomos de F se aproximan hasta compartir dos electrones, de manera que un electrón del átomo A "encaja" en el hueco del átomo B y un electrón del átomo B "encaja" en el hueco del átomo A. De ese modo, cada uno de los dos átomos de F consigue tener su octete. Otra manera de representar lo descrito en el dibujo anterior es la siguiente: F F Observa que en torno al símbolo de cada uno de los átomos se han dibujado con puntos los electornes de su última capa. Cuando ya se ha formado el enlace entre los dos átomos para constituir la molécula, los electrones compartidos han quedado dibujados entre los dos átomos unidos. Los electrones compartidos unen los dos átomos. Podriamos pensar que la zona donde se hallan los electrones compartidos será una zona "muy negativa". Por ser negativa, atraerá fuertemente a los núcleos (positivos) de ambos átomos, con lo cual los mantendrá unidos. + - + 16.- Tú mismo puedes ir dibujando los electrones en la formación de los siguientes enlaces: Molécula de cloruro de hidrógeno: Molécula de Cloro ( Cl2 ): Molécula de hidrógeno: (H2) Molécula de oxígeno (O2) Molécula de Nitrógeno (N2): Molécula de dióxido de carbono (CO2): Molécula de agua (H2O): Molécula de Amoníaco (NH3): Para representar los enlaces covalentes, se utilizan guiones. Cada guión equivale a dos electrones compartidos entre los dos átomos enlazados. He aquí la estructura de la molécula de butano: 17.- Comprueba el número de electrones que tiene cada átomo de C y cada átomo de H Las uniones intermoleculares en las sustancias con enlaces covalentes. Imagínate un recipiente conteniendo moléculas de Cl2. No hay ninguna razón para que entre dos molécuals vecinas surjan fuerzas atractivas. Por eso se dice que, en las sustancias covalentes, las uniones intermolecualres son muy débiles o inexistentes. Comparando la fortaleza de los enlaces intermoleculares intramoleculares en las sustancias iónicas y covalentes: e Observa el siguiente dibujo: 18.- Puedes completar el siguietne cuadro utilziadno las palabras fuertes, muy fuertes, débiles,. SUSTANCIAS IÓNICAS SUSTANCIAS COVALENTES Enlaces intramoleculares Enlaces intermoleculares 5.- Las propiedades de las sustancias iónicas: descripción y explicación. A.- Los puntos de fusión y ebullición: Los cambios de estado (fusión, ebullicición, ...) afectan a los enlaces intermoleculares. Esto ya lo sabias. Si un enlace intermolecular es muy fuerte, habrá que suministrarle mucha energí apara romperlo (o debilitarlo). Eso significará que esa sustancia fundiará y hervirá a altas temperaturas. 19.- Acabas de ver que en los compuestos iónicos las uniones intermoleculares son de igual naturaleza que las uniones intramoleculares. También has visto que en las sustancias covalentes, las uniones intermoleculares son muy débiles. A partir de ese dato, se podrán deducir las siguientes propiedades: a.- Los compuestos formados con enlaces iónicos funden a bajas temperaturas.F b.- Los compuestos formados con enlaces iónicos funden a altas temperaturas. V c.- Los compuestos formados con enlaces iónicos hierven a altas temperaturas. V d.- Los compuestos formados con enlaces iónicos hierven a bajas temperaturas. F e.- Cada ion positivo atrae a un solo ion negativo, formándose moléculas aisladas. F f.- Las sustancias covalentes pasarna fácilmente a estado gaseoso. V g.- Las sustancias covalentes pasarán a estado gaseoso más fácilmente que las sustancias iónicas. V h.- Las sustancias covalentes tendrán altos puntos de fusión y de ebullición. F 20.- Observa los siguientas datos y trata de darles alguna explicación: NaCl Cl2 Pto. Fusión ºC 801 -102 Pto. Ebullición ºC 1.413 -36 O2 -218 -182 N2 -210 -195 Agua 0 100 B.- El aspecto físico: En los dibujos inferiores dibuja los enlaces que crees que hay entre los átomos o los iones dibujados. En el caso de la sustancia iónica, los enlaces unen a todas los iones. Formarán una estructura ordenada. Será un cristal. La sustancia tiene aspecto cristalino. Es lo que sucede con la sal. En el caso de la sustancia covalente, las moléculas son muy independientes unas de otras. No hay uniones (prácticamente) entre ellas. Las moléculas no guardarán entre ellas ningún orden. Serán sustancias amorfas. Cl + - + - Cl Cl Cl Cl - + - + + - + - Cl Cl Cl Cl Cl Cl Cl C.- La conductividad eléctrica: Para que una sustancia sea conductora de la corriente eléctrica es necesario que algunas paríclas cargadas eléctricamente puedan moverse y así transmitir la electricidad de un punto a otro. Las sustancias iónicas tienen partículas cargadas. Pero están muy fijadas, de manera que no pueden moverse. Es imposible el transporte de cargas eléctricas. Pero si la sustancia se disuelve o se funde (se debilitan las uniones) cada ión ya podrá desplazarse. La suatcnai será conductora de la corriente eléctrica. Por el contrario, las sustancias covalente, no tienen partíuclas cargadas eléctricamente. Aunque sus moléculas puedan moverse, no transportarán carga eléctrica y por tanto no serán conductoras de la corriente eléctrica. 21.- Resumen de las propiedades de las sustancias iónicas. Redondea con un círculo la opción correcta: SUSTANCIAS IÓNICAS Puntos de fusión y Aspecto físico Conductividad eléctrica ebullición Altos P. fusión y P. ebullición Cristalino Siempre son conductoras Bajos P. fusión y P. ebullición No-cristalino Sólo en estado sólido Sólo en estado líquido (fundidas o disueltas) No conducen nunca la corriente. SUSTANCIAS COVALENTES Puntos de fusión y Aspecto físico Conductividad eléctrica ebullición Altos P. fusión y P. ebullición Cristalino Siempre son conductoras Bajos P. fusión y P. ebullición No-cristalino Sólo en estado sólido Sólo en estado líquido (fundidas o disueltas) No conducen nunca la corriente. El enlace metálico Los átomos metálicos se enlazan de la siguiente manera: Los átomos se disponen ordenadamente en los vértices de una red imaginaria. Cada átomo se desprende de los electrones de su último nivel (que lo tenía incompleto) y esos electrones los vierte en el centro de la red, donde coincidirán con los electornes vertidos por los demás átomos. En cada vértice quedará un ión positivo que tendrá sus niveles electrónicos semejantes a los de los gases nobles. En el centro de la red habrá un conjunto de electrones (nube electrónica) que no pertenecen directamente a ninguno de los átomos sino que pertenecen a todos los átomos simultáneamente. Serán electrones no ligados y que por tanto podrán despzlarse por la red. Ellos serán lso responsables de la conductividad eléctrica que presentan los metales. 20.- Señala diferencias entre las redes de los compuestos iónicos y las redes de los metales. VËRTICES ESPACIO INTERSTICIAL E. IONICO Iones + y - E. METÄLICO Iones + Nada Nube electrónica