OTROS TEMAS SOBRE LA LUZ
Anuncio

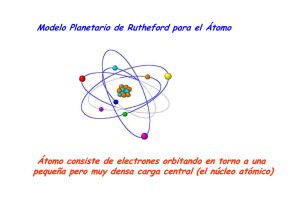
OTROS TEMAS SOBRE LA LUZ 1.- La luz y los átomos La materia (es decir, todos los objetos) está formada por átomos. Los átomos son los encargados de liberar fotones de luz, pero para que esto suceda algunos de sus electrones tienen que ser primeramente excitados. Esto se consigue siempre dando energía a esos átomos. Por ejemplo, calentando el objeto, iluminándolo con una bombilla o mediante la luz procedente del Sol, etc. Un ejemplo de esto es el hecho de ver los objetos coloreados cuando se iluminan. Esta iluminación supone que al objeto le llega luz (normalmente luz blanca), la cual es absorbida por sus átomos y con ello, dichos átomos se excitan (aumenta su energía). Posteriormente, los mismos átomos se desexcitan y emiten luz de un color diferente, que es el color del que vemos el objeto. Por otra parte, también existen fuentes de luz propia, como es el caso de las estrellas, cuyos átomos se excitan porque en el interior de una estrella se producen reacciones nucleares de muy alta energía. Así, las estrellas emiten luz blanca en todas las direcciones. (A la derecha podemos observar una estrella excitada en el espacio junto a otras). 2. ¿Por qué emite luz un átomo? Un átomo excitado, es decir, al que se le ha aportado energía extra (por ejemplo, calentándolo, iluminándolo, etc.) es inestable y vuelve al estado fundamental emitiendo la energía recibida en el impacto, en forma de luz. El proceso de des-excitación se produce con el salto de uno de los electrones del átomo de un nivel de energía alto a otro de energía más bajo. La diferencia de energía entre ambos niveles, se emite como un fotón de luz de un determinado color o longitud de onda. En los dibujos adjuntos se representa este proceso para un mismo átomo emitiendo luz de dos colores diferentes. En el dibujo situado a la izquierda, la diferencia entre los niveles de energía entre los que salta el electrón es mayor. Al des-excitarse, el átomo pierde una mayor cantidad de energía y emite un fotón de luz azul (longitud de onda más corta). En el dibujo situado más a la derecha, la diferencia entre los niveles de energía entre los que salta el electrón es menor. El átomo pierde una cantidad menor de energía y emite un fotón de luz roja (longitud de onda más larga). 3. Espectro de emisión atómica El espectro de emisión atómica es el conjunto de frecuencias o de longitudes de onda que puede emitir cada tipo de átomo, cuando se des-excita, después de que se le ha comunicado energía. Cada elemento químico tiene unos determinados niveles de energía únicos y, por tanto, puede emitir únicamente unos determinados colores de luz, que se corresponden con los saltos que pueden realizar sus electrones en el proceso de des-excitación. Por ejemplo, en la fotografía adjunta se muestra el espectro de emisión del átomo de hidrógeno, en este caso, producido después de que se haya excitado gas hidrógeno en su tubo de vidrio, al aplicarle un voltaje de 5000 voltios procedentes de un transformador. Cada línea coloreada de este espectro corresponde a uno de los saltos que puede dar el electrón del átomo de hidrógeno, cuando el hidrógeno se desexcita.s