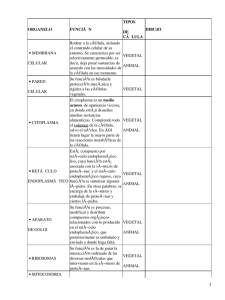
Citología e Histología animal y vegetal
Anuncio

Asignatura: CitologÃ−a animal (y vegetal) Duración: 1 Cuatrimestre Examen CitologÃ−a: Viernes, 25 Enero 2008 (Parcial tipo test) Estructura del curso: Asignatura “CitologÃ−a e HistologÃ−a animal y vegetal”: • Primer cuatrimestre solo CitologÃ−a (células) • Segundo cuatrimestre solo HistologÃ−a (tejidos) Hay un parcial para cada asignatura: • CitologÃ−a: 25 de Enero 2008 • HistologÃ−a: última semana de Mayo o primera semana de Junio Cada parte se aprueba independientemente con un 5 de nota. Las practicas hay que tenerlas aprobadas por separado. Examen final de recuperación o para subir nota: 16 de Junio • Solo la parte de la asignatura no aprobada • Solo alumnos suspensos o para subir nota (hacer AMBOS exámenes!) Examen de prácticas a finales de Junio para todos los alumnos Modo de llevar el curso: • Aprobar los parciales por separado es mas fácil que el examen final • Revisar apuntes de 2º de Bachillerato • Libro recomendado: B. Alberts, BiologÃ−a de la célula • Sacar periódicamente hojas de PowerPoint en reprografia Repaso: Clasificación de los seres vivos • Bacterias y Arqueobacterias (Procariotas) • Células Eucariotas • Viruses Viruses: • Cadena de ADN o ARN • Cadena lineal o circular • Una o dos cadenas • No pueden reproducirse por si solas, reproducción parasitaria Bacterias procariotas: 1 • Pared y membrana celular • ADN con varias copias • Anucleadas (sin núcleo ni nucleolo) • Pueden tener flagelo, aunque es totalmente diferente al de las células eucariotas • No tienen citoesqueleto • Los ribosomas son de composición y tamaño diferentes (70S frente a 80S de las células eucariotas) • Ribosomas de Mitocondrias y Cloroplastos son de tamaño similar (70S) debido a su probable origen · Estructura de la Membrana Plasmática (MP): • Estructura básica de todas las membranas biológicas: Bicapa lipÃ−dica • ProteÃ−nas: Se encargan de las funciones que hay que hacer en la membrana • La membrana plasmática es fluida y dinámica • La membrana plasmática es un limite con el medio: barrera y vehÃ−culo de comunicación entre el interior y el medio externo de la célula • Al ME (Microscopio Electrónico): La MP aparece como una estructura trilaminar (dos lÃ−neas densas y oscuras con un centro mas claro) · Funciones generales de la Membrana Plasmática: • Son desempeñadas por las proteÃ−nas intercaladas en la membrana • Compartimentan la célula, separan interior de exterior • Regulan el paso de substancias: la MP es selectivamente permeable • Transferencia de información: hay receptores para la “transducción de señales” • Actividad enzimático • Otras: Adhesión de la célula al medio, movimiento, secreción conducción del impulso nervioso · Composición quÃ−mica: • La membrana plasmática esta compuesta por: LÃ−pidos, ProteÃ−nas e hidratos de carbono • LÃ−pidos: FosfolÃ−pidos, colesterol y glicolÃ−pidos • Fosfolipidos: • Fosfatidilcolina • Esfingomielina • Fosfatiletanolamina • Fosfatilserina (con una carga neta negativa, se encarga de la apoptosis) • FosfolÃ−pidos de inositol • Los fosfolÃ−pidos tienen una cabeza polar hidrofÃ−lica y dos cadenas de ácidos grasos (12-14 átomos de carbono) hidrofóbicas • Una de las cadenas es saturada y la otra insaturada, por lo que tiene una curvatura en la cadena que permite mejor movilidad de los lÃ−pidos • Movimiento: los fosfolÃ−pidos se mueven por difusión lateral, giran alrededor de su eje longitudinal, flexionan sus cadenas y pueden intercambiar su posición de una monocapa a otra (Flip-Flop) aunque es poco frecuente y lento • Los fosfolÃ−pidos tienen la propiedad de que se AUTOENSAMBLAN en bicapas cuando entran en contacto con un medio acuoso • Tambien tienen la propiedad del AUTOSELLADO, gracias a la cual se cierran en esferas • FosfolÃ−pidos (continuación): ♦ Los fosfolÃ−pidos se distribuyen ASIMà TRICAMENTE en la bicapa: 2 ♦ En la monocapa externa preferentemente: · la esfingomielina y · la fosfatidilcolina ♦ En la monocapa interna preferentemente: · la fosfatidilserina (negativa, apoptosis), · fosfatilinositol (transductor de señales, poca cantidad) · fosfatiletanolamina 2) Colesterol: ♦ Son anfipáticas (bipolares): · cabeza polar: hidroxilo -OH · Apolar: cuarto anillos esteroides y una cola hidrocarbonada ♦ Se encuentran en abmas nonocapas lipÃ−dicas entre los fosfolÃ−pidos ♦ El colesterol da rigidez a la membrana plasmática ♦ Cuanto mas colesterol, mas impermeable y mas rigida (inmóvil) es la membrana ♦ En la membrana plasmática de las células puede haber microdominios (como islas o “rafts”) con mayor concentración de colesterol y que suelen tener determinadas proteÃ−nas. ♦ LÃ−pidos (continuación) ◊ GlicolÃ−pidos: (ver tema de los Hidratos de Carbono) Prefijo “Glico-“ viene de los azucares, hidratos de carbono. ♦ ProteÃ−nas: ◊ Las funciones ya se vieron el dÃ−a 03.10.07 ◊ Hay 2 tipos de proteÃ−nas (Fig. 13): Integrales (o transmembranales) y periféricas · ProteÃ−nas Integrales: ◊ Las proteÃ−nas integrales atraviesan completamente la bicapa lipÃ−dica. Pueden ser de paso único (la atraviesan una vez) o de paso múltiple. ◊ Suelen tener estructura alfa-hélice, aunque algunas son de estructura Beta-laminar, que adoptan forma de barril. ◊ Los residuos (partes, o, en este caso, aminoácidos que la componen) de las proteÃ−nas integrales no tienen carga (apolares) para no repeler las colas de la bicapa lipÃ−dica. ◊ Los aminoácidos con carga se sitúan fuera de la monocapa externa siempre. ◊ Debido a que tienen una parte polar y otra apolar, también son Anfipáticas. ◊ Hay proteÃ−nas transmembranosas que tienen aminoácidos con Azufre (S). En el dominio externo de la bicapa, estos forman puentes de disulfuro (S-S), pero en el dominio interno (que da al citosol), esto no ocurre y quedan hidrogenados (-SH). ◊ También aparecen en el medio externo cadenas de Oligosacáridos (Oligo- = corto), cortas cadenas ramificadas de hidratos de carbono. ◊ Los grupos carboxilo o amino que se encuentran al final de las proteÃ−nas integrales pueden estar en el dominio interno, en el externo o en ambos, pero una misma proteÃ−na siempre permanecerá en esa posición y no puede cambiarse. (Fig. 15) ♦ ProteÃ−nas: · ProteÃ−nas Periféricas: 3 ◊ En el dominio interno, las proteÃ−nas periféricas se encuentran ligadas/unidas covalentemente a ácidos grasos. ◊ En el dominio externo, las proteÃ−nas periféricas se encuentran unidas a GlicolÃ−pidos. ◊ También hay proteÃ−nas periféricas en ambos dominios que no están unidos covalentemente. · Proteoglicanos (PGs): ◊ Es posible encontrar Proteoglicanos (PGs) en la membrana plasmática, y son proteÃ−nas transmembranosas. ◊ Entre las funciones de los Proteoglicanos están la unión/adhesión de la célula a la matriz extracelular y la de ser capaces de responder a los estÃ−mulos del medio externo y transmitirlos al medio interno. ◊ Los PGs son como las glicoproteinas, solo que con cadenas de carbono largas (200+ de residuos) y lineales, en vez de cortos y ramificados. ◊ Las proteÃ−nas se sintetizan en el RetÃ−culo endoplasmático rugoso (RER), pero no todas (Fig. 28). Las transmembranosas si se sintetizan en el RER. ♦ Hidratos de Carbono: ◊ Solo se encuentran en la monocapa externa ◊ Son cortos y ramificados (de menos de 15 residuos) ◊ Están unidos covalentemente a ProteÃ−nas (Glico/GlucoproteÃ−nas) o a lÃ−pidos (GlicolÃ−pidos). ◊ Entre los 9 monosacáridos mas abundantes se encuentran: Galactosa, Manosa, Fructosa, Glucosa y Acido Siálico (N-acetilneuraminico o “nana”) ◊ Glicolipidos importantes: Galactocelebrosidos (mielina) y Gangliósidos (Membrana plasmática de las neuronas) · Eritrocitos (= glóbulos rojos o hematÃ−es): ♦ Su membrana plasmática es la mas estudiada y conocida de todas las células, ya que es fácil de obtener y de separar su MP del resto de la célula (metiéndolos en un medio hipotónico) (Fig.19) · Definición Glicocálix: ♦ Es la cubierta rica en hidratos de carbono que rodea la célula y que puede observarse al microscopio electrónico de transmisión (MET). (Fig.20) Funciones: ♦ Protección mecánica y quÃ−mica de la célula ♦ Identificación y reconocimiento entre células (fecundación o la extravasación de los glóbulos blancos (leucocitos) desde los vasos sanguÃ−neos al ligar donde haya una infección. (Fig.23) · Resumen del tema 2. Membranas Celulares: ♦ La membrana plasmática sigue un sistema de “mosaico fluido”, lo que quiere decir que las proteÃ−nas pueden moverse. ♦ Contiene proteÃ−nas periféricas de membrana, carbohidratos y proteÃ−nas integrales ♦ No siempre las proteÃ−nas deben desplazarse por la membrana plasmática, puede que por determinadas razones no deba hacerlo. Para ello las células han desarrollado distintos mecanismos para restringir la movilidad: • mediante interacciones con macromoléculas del medio externo • mediante interacciones con moléculas del medio interno de la célula 4 • mediante interacciones con proteÃ−nas de la membrana plasmática de otra célula (Fig.27) · Transporte a través de membranas: ♦ Existe una desigualdad de los componentes del exterior y del interior de la célula, especialmente de iones sodio (Na+) y potasio (K+) (Fig.1) ♦ La célula tiene una membrana de “permeabilidad selectiva” (o semipermeable). Esto significa que no deja pasar todas las sustancias de un lado de la bicapa a otro. ♦ Para que las sustancias puedan pasar a través de la membrana, la célula dispone de tres mecanismos: 1) Difusión simple Transporte pasivo 2) Difusión facilitada Transporte pasivo 3) Transporte activo 4) Transporte activo secundario • Difusión simple: ♦ La difusión simple es el paso directo a través de la membrana plasmática. ♦ Solo pueden hacerlo sustancias que sean suficientemente pequeñas y no tengan carga, ya que el interior de la bicapa lipÃ−dica es hidrófobo. ♦ La difusión simple siempre es a favor de gradiente. ♦ Aunque el agua (H2O) entra en la célula mediante difusión simple, se ha descubierto que en la membrana plasmática existen unos canales especÃ−ficos para el agua y que se han dado en llamar “acuaporinas”. (Fig.2) • Difusión facilitada: ♦ Las moléculas demasiado grandes o con carga (como la glucosa o los aminoácidos) como para pasar a través de la membrana plasmática por difusión simple, necesitan ayuda de proteÃ−nas que facilitan su paso. Hay dos tipos: • ProteÃ−nas transportadoras (“carriers” o permeasas): ♦ Transportan solutos especÃ−ficos a favor de gradiente. ♦ El soluto se adhiere a la proteÃ−na y luego esta cambia de forma, permitiendo la salida del soluto al otro lado de la membrana plasmática (Fig.5). ♦ (Fig.6) ProteÃ−na transportadora especÃ−fica de la glucosa. ♦ Si solo transportan una molécula, se llaman “uniporte”. Si transportan dos moléculas diferentes se llaman “cotransporte”. ♦ Las proteÃ−nas cotransporte pueden transportar ambas moléculas en el mismo sentido (“simporte”) o en el contrario (“antiporte”) 2) Difusión facilitada (continuación): b) ProteÃ−nas de canal: ♦ Las proteÃ−nas de canal son proteÃ−nas transmembranosas que presentan una especie de canal a través de la membrana plasmática. ♦ Sirven para transportar sobre todo iones y son muy especÃ−ficos. ♦ Algunas proteÃ−nas de canal tienen una compuerta que puede cerrarse, y por lo general no suelen estar permanentemente abiertas. (Fig.11) ♦ Hay dos tipos de proteÃ−nas de canal: • de ligando: Necesitan que se les una un ligando para abrir el paso. • de voltaje: Se abren por un cambio de voltaje en la membrana (70 minivoltios aprox.) 5 Ejemplo: Unión neuromuscular: ♦ La acetilcolina (neurotransmisor) es segregada por la terminación del axón (botón sináptico) y se une a las proteÃ−nas de canal de la célula del músculo estriado, haciendo de ligando. ♦ Cuando se abren los canales, pueden entrar los iones sodio (Na+) necesarios para la contracción muscular. (Fig. 7 y 9) 3) Transporte Activo: ♦ El transporte activo es siempre contra gradiente y por tanto supone un gasto de energÃ−a. ♦ Las encargadas del transporte activo son unas proteÃ−nas transportadoras de la membrana plasmática. ♦ La bomba Sodio (Na+)-Potasio (K+) es el mejor ejemplo de transporte activo. (Fig 1) ♦ La bomba de sodio-potasio bombea activamente sodio(Na+) hacia el exterior y potasio (K+) al interior de la célula, hidrolizando ATP (ATP ADP + Pi) ♦ EN cada ciclo de la bomba sodio-potasio, salen 3 iones sodio (Na+) al medio externo y entran 2 iones potasio(K+), gastándose una molécula de ATP. (Fig. 13). ♦ La bomba sodio potasio es fundamental para que la célula pueda vivir, y consume un tercio (1/3) de la energÃ−a que genera la célula. (Fig. 12 y 13) 4) Transporte activo secundario: ♦ El transporte activo secundario es un tipo especial de transporte a través de la membrana, que se da por ejemplo para el transporte de la glucosa en las células epiteliales del intestino delgado. ♦ El transporte activo secundario es un transporte en contra de gradiente, en el que una molécula de glucosa y dos iones sodio (Na+) entran a través de unas proteÃ−nas transmembranosas especiales situadas en las microvellosidades de la célula epitelial del intestino delgado en la célula. (Cotransporte, simporte) (Fig 14) ♦ Los iones Na+ entran a favor de gradiente, ya que en la células siempre hay menos que en el medio externo. ♦ Para sacar otra vez los iones sodio (Na+) de la célula, es necesario que actúe la bomba sodio-potasio, la cual gasta un tercio de la energÃ−a que produce la célula. ♦ EL transporte activo secundario es indirectamente activo debido justamente a que se gasta energÃ−a indirectamente cuando la bomba sodio-potasio tiene que expulsar los iones sodio (Na*) que han entrado con la glucosa. Estas bombas se encuentran en el dominio basolateral. (Fig 15) ♦ La glucosa luego debe abandonar la célula epitelial del intestino delgado mediante difusión facilitada al fluido extracelular (Fig. 16). ♦ Las proteÃ−nas de la membrana plasmática pueden difundirse (moverse) por ella debido a las propiedades de la bicapa lipidica. Por ello la célula tiene unas “uniones herméticas” en la juntura con la celula epitelial vecina para evitar que las proteÃ−nas transportadoras transmembranosas especificas encargadas de facilitar el paso a las glucosas no se muevan fuera de las microvellosidades y de la Luz del intestino delgado. (Fig. 17) Resumen del tema (Fig. 18) ♦ Añadimos que las membranas plasmáticas no son las únicas que tienen el mismo funcionamiento en cuanto al traspaso de sustancias de un lado a otro de la bicapa. · Transporte de macromoléculas: ♦ Existen dos situaciones para transportar macromoléculas: La endocitosis y la exocitosis. · Endocitosis: 6 ♦ Formación de vesÃ−culas rodeadas de membrana creadas a partir de invaginaciones de la membrana plasmática que engloban o contienen en su interior las macromoléculas. · Exocitosis: ♦ Proceso inverso a la endocitosis en el que las vesÃ−culas rodeadas de membrana se fusionan con la membrana plasmática, incorporándose a esta y liberando al medio externo su contenido. ♦ Todas las células del organismo (humano) son capaces de hacer la endocitosis. Existe un tipo especial de endocitosis llamado “endocitosis mediada por receptor”, que permite que la célula capture macromoléculas especificas. ♦ En esta endocitosis selectiva participan una serie de proteÃ−nas situadas justo debajo de la membrana plasmática, en unas zonas que se encuentran hundidas (deprimidas) en la membrana de la célula y que se llaman “depresiones revestidas”. ♦ Las proteÃ−nas especificas del revestimiento son la Clastrina y la Adaptina. · La clastrina es una proteÃ−na que esta formada por tres cadenas pesadas (=muchos aminoácidos) y tres cadenas ligeras que adquieren cada molécula la forma de tres patas (trisquelión) (Fig. 2 y 3) Las moléculas de clastrina se ensamblan entre si formando poliedros con caras hexagonales y pentagonales que recuerdan a la red de las canastas de baloncesto. En las depresiones revestidas se sitúan los receptores especÃ−ficos para determinadas macromoleculas y que son proteÃ−nas transmembranosas. · Las adaptinas son los encargados de reconocer a las macromoléculas en el dominio de la célula que da al medio externo. A su vez, las adaptinas son rodeadas por moléculas de clastrina. (Fig. 5, 6 y 7) Poco después de que se forme la vesÃ−cula porque haya actuado la dinamina (estrangulador de la vesÃ−cula que separa la misma de la membrana plasmática), la vesÃ−cula pierde su revestimiento. El ejemplo mas estudiado de endocitosis mediada por receptor es la de la endocitosis de proteÃ−nas LDL (lipoproteÃ−nas de baja densidad) y que contienen moléculas de colesterol que la célula necesita incorporar como fuente de colesterol para reponer las membranas. Cada partÃ−cula de LDL (colesterol malo) esta formado por una monocapa de fosfolÃ−pidos junto con colesterol y una proteÃ−na. En el interior de esta cubierta se encuentran los ésteres de colesterol. (Fig. 8) ♦ Los receptores para partÃ−culas de LDL se acumulan en las depresiones revestidas de adaptias y clatrinas. ♦ Cuando la depresión se va invaginando, la partÃ−cula de LDL se mantiene unida al receptor porque hay un reconocimiento entre los receptores de la partÃ−cula y del receptor. (Fig.9) ♦ A continuación se produce la estrangulación de la yema y se forma la vesÃ−cula revestida en el citosol ♦ Al poco tiempo esta vesÃ−cula pierde su revestimiento de clatrina y adaptina y a su vez se une a otras vesÃ−culas del citosol para formar el “endosoma temprano”, en el que se liberan las vesÃ−culas que contienen al receptor y que lo reciclan al volver a la membrana plasmática. ♦ Después de esto, se produce la fusión con lisosomas que contienen encimas hidrolÃ−ticas que rompen (hidrolizan) los esteres de colesterol (Fig.10) ♦ La célula tiene otra forma de obtener colesterol, a partir del RetÃ−culo endoplasmático listo (REL), aparte de la endocitosis. 7 ♦ En la endocitosis mediada por receptor no siempre hay una fusión con lisosomas. Existe un proceso que se denomina transcitosis en el que una molécula entra en la célula por endocitosis mediada por receptor y sale por otro lado de la célula sin ser degradada por los lisosomas. ♦ Un ejemplo es el paso de los anticuerpos que hay en la leche materna a través de las células del epitelio del intestino delgado del lactante. (Fig.11) · Transporte de macromoléculas por Fagocitosis: ♦ Algunas pocas células del organismo son capaces de practicar la Fagocitosis, que consiste en incorporar microorganismos o células (que ya han acabado su trabajo) mediante pseudópodos al interior de la célula para ser descompuesta. ♦ Los neutrófilos y macrófagos son dos ejemplos de células fagodcitantes, las cuales tienen una función defensiva muy importante. ♦ La célula incrorpora estos microorganismos rodeándolos de una membrana, para luego fusionarlos con un lisosoma y degradarlo.(Fig.12) ♦ Macrófago fagocitando eritrocitos (Fig. 13) · La exocitosis: ♦ Funciona exactamente igual que la endocitosis, pero en sentido inverso. ♦ Un ejemplo clásico es la “Degranulacion de los mastocitos”, que son unas células situadas ene l tejido conjuntivo que contienen gran cantidad de gránulos rodeados de membrana en su interior. Cuando reciben una señal especifica, liberan el contenido en histamina al medio externo por exocitosis (Fig. 15). ♦ En las células existen dos tipos de secreción (exocitosis): Constitutiva, que la poseen todas las células y Regulada, que solo la tienen algunas células especializadas en la secretacion, y que se activan con una señal, como los mastocitos. (Fig. 16) · La matriz extracelular (MEC): ♦ Ocupa el espacio entre las células y esta especialmente desarrollada en los tejidos conjuntivos, donde es secretado por los fibroblastos. Contiene gran cantidad de macromoléculas secretadas por las células. · Funciones de la Matriz extracelular (MEC): ♦ Función estructural: Soporte mecánico al tejido. ♦ Función Reguladora: migración, proliferación, forma y funciones metabólicas de las células en contacto con ella. Se investiga en gran medida la migración y proliferación de las células para comprender mejor el cáncer. ♦ MEC (Fig.1): Debajo de todo epitelio de revestimiento existe un tejido conjuniv. Ambos tejidos estan separados por la “lamina basal” que es un tipo especial de Matriz Extracelular. ♦ En el tejido conjuntivo hay mastocitos, fibroblastos y macrófagos, y todo lo que los rodea es considerada la MEC. · Composición de la Matriz extracelular (MEC): ♦ Agua (H2O) ♦ Macromoléculas : • Glucosaminoglicanos (GAGs), muchos unidos a proteÃ−nas (Proteoglicanos) • ProteÃ−nas: Estructurales (colágeno y elastina en fibras) y Adhesivas (Fibronectina y otros) ♦ Frecuentemente los histólogos denominan “Sustancia Fundamental” a la mezcla entre H2O, GAGs yu PGs, la cual es altamente hidratada, con propiedades de gel y que permite la difusión de nutrientes, hormonas, etc entre la sangre y las células. 8 • Glucosaminoglicanos: ♦ La mayorÃ−a de los glucosaminoglicanos (GAGs) están unidos a Proteoglicanos (Fig.2) ♦ Los principales Gluciproteglicanos son: Acido Hialuronico (Fig.3), Dermatán sulfato, CondrotÃ−n sulfato, Queratan sulfato y heparan sulfato. ♦ Los glucosaminoglicanos son plisacaridos lineales no ramificados, donde la unidad que se repite es un disacárido con muchas cargas negativas. ♦ Excepto el Acido hialurónico, normalmente se unen a proteÃ−nas para formar Proteoglicanos. ♦ Al tener gran carga negativa retienen agua (H2O) (Fig.4) b) ProteÃ−nas Estructurales: Son el colágeno y la elastina. Colágeno: ♦ Es la proteÃ−na mas abundante del organismo y se han identificado mas de veinte tipos distintos de colágenos. ♦ Una vez sintetizadas, las moléculas de colágeno, que forman una triple hélice y que se forman en el interior de los fibroblastos, son secretadas a la matriz extracelular, donde se asocian muy ordenadamente, formando en la mayorÃ−a de los casos fibras de colágeno. ♦ El colágeno de Tipo IV es el que hay en la lámina basal. (Fig.5, 6 y 6) Elastina: ♦ Las moléculas de elastinas también forman fibras en la Matriz extracelular del tejido conjuntivo. ♦ Tiene la propiedad de que forman uniones cruzadas con otras moléculas de elastina, de modo que son capaces de estirarse y relajarse (Fig.7) ♦ Se sitúan por ejemplo en la Aorta, que necesita expandirse, o en la dermis, que es el tejido conjuntivo debajo de la epidermis y en la cual con la edad, la perdida y falta de elastina, son la razón de las arrugas. b) ProteÃ−nas adhesivas: ♦ La principal molécula de adhesión de la Matriz extracelular en el tejido conjuntivo es la fibronectina. (Fig.8) ♦ Cada molécula de fibronectina esta formada por dos cadenas peptÃ−dicas unidas por dos puentes de disulfuro en la terminal carboxilo. ♦ Cada molécula tiene múltiples dominios para poder unirse a Proteoglicanos, colágeno y otras para unirse a los receptores de las células (integrinas). · Las Integrinas: ♦ Son receptores de la membrana plasmática de las células y están formadas por dos subunidades glucoprotéicas transmembranosas (alfa y beta). ♦ Necesitan cationes divalentes para actuar (calcio o magnesio). ♦ Actúan de integradoras transmembranosas, participando en la interacción entre el citoesqueleto del interior de la célula (microfilamentos de actina) y las moléculas de la matriz extracelular. ♦ Unas pocas integrinas de la célula actúan con integrinas de otras células (Fig.10) ♦ La interacción de la integrina con los microfilamentos de actina del citosol no es directa, sino que es a través de otras proteÃ−nas (Fig 11) · Adhesión celular: ♦ Es fundamental durante el desarrollo embrionario, pero también en los adultos. ♦ Se produce por interacciones entre las superficies celulares. ♦ Estas interaccionas no dan lugar a estructuras que puedan observarse al microscopio 9 electrónico. ♦ Hay 3 formas o mecanismos de adhesión: • HomofÃ−lica: Se da entre dos moléculas idénticas en ambas células (Fig.1) • HeterofÃ−lica: Dos células se adhieren por moléculas de la superficie que son distintas entre si. • Tercer mecanismo: Adhesión entre células a través de las moléculas de la matriz extracelular, que actúan uniéndolos. Se dan pocos casos. ♦ Existen 4 familias de proteÃ−nas que intervienen en la adhesión celular: 1) Cadherinas (homofÃ−licas) • IG CAMs (homofÃ−licas) • Selectina (HeterofÃ−licas) • Integrinas (HeterofÃ−licas) ♦ Estas cuatro familias pueden participar en la adhesión célula-célula y en la adhesión célula-MEC (Fig.2) • Las Cadherinas: Son proteÃ−nas transmembranosas con largo dominio extracelular que requieren que se les unan iones calcio (Ca++) para poder funcionar. El extremo amino esta en el medio externo, el extremo carboxilo en el citosol, actuando como dÃ−meros, provocando una union homofÃ−lica entre dos células (Fig.3). Por el extremo carboxilo del citosol, las Cadherinas son capaces de interaccionar con el citoesqueleto (concretamente con los microfilamentos de actina), a través de unas proteÃ−nas que se llaman Cateninas (α, β, γ o p120). • Ig CAMs: Se llaman asÃ− porque presentan dominios similares a los de los anticuerpos. En concreto es una proteÃ−na transmembranosa con un largo dominio extracelular en que cada molécula tiene 5 lazos unidos por puentes de disulfuro. La unión entre las células mediante Ig CAMs es homofÃ−lica e independiente de iones Calcio (Ca++) (Fig.4). 3) Selectinas: Son proteÃ−nas transmembranosas con un largo dominio extracelular que reconocen un determinado oligosacárido (hidrato de carbono) en la membrana plasmática de otra célula. Son dependientes del Calcio (Ca++) y tienen un papel fundamental en la extravasación de los leucocitos desde los vasos sanguÃ−neos al lugar de la infección, tal y como ya se vio. (Fig.5) 4) Integrinas: Esta formada por dos cadenas polipeptÃ−dicas y transmembranosas, que necesitan iones Calcio o magnesio. (Fig.9 del tema 4). En el citosol se unen a microfilamentos de actina y en el medio externo a la Fibronectina, tal y como también se ha visto en el tema anterior. · Diferenciaciones de la membrana plasmática 10 • Apicales: • Cilios y flagelos • Microvellosidades • Laterales: 2.1) Uniones herméticas 2.2) Bandas de adhesión 2.3) Desmosomas 2.4) Comunicantes (nexos/gaps) • Basales: 3.1) Hemidesmosomas 3.2) contactos basales (placas de adhesión) • Apicales: • Cilios y flagelos: Una célula suele tener muchos cilios, pero solo un flagelo. Tanto los cilios como los flagelos estan formados por microtubulos, en una disposición (9 2): 9 dobletes de microtubulos alrededor de un par central. Estas diferenciaciones sirven para que se mueva la célula en el caso de los flagelos (ej. Espermatozoide) o para desplazar alguna secreción u otra célula, como se da en el caso de las células epiteliales de las trompas de Falopio que transportan el óvulo. También en el aparato respiratorio, las células del epitelio tienen cilios para extender el mucus donde quedan atrapados las partÃ−culas sólidas que van en el aire. • Microvellosidades: Son prolongaciones en forma de dedos de la membrana plasmática que tienen por función el aumento de la cantidad de membrana de contacto. En las células del epitelio del intestino delgado por ejemplo, permiten una mayor superficie de absorción. En el interior de cada microvellosidad hay un haz de microfilamentos de actina. (Fig. 1 y 2) 2) Laterales: 2.1) Uniones herméticas (estrecha/ocluyente): Están presentes en muchos tipos de células, pero las mas estudiadas son las del epitelio del intestino delgado. Las uniones herméticas son diferenciaciones de la membrana plasmática que se localizan en la parte lateral, justo por debajo de las microvellosidades. Hasta hace pocos años se pensaba que las membranas plasmáticas de ambas células adyacentes se fusionaban en una sola, pero actualmente 11 se sabe que no es asÃ−. Cada unión hermética esta formada por unas hileras o filas de proteÃ−nas transmembranosas conectadas entre si y que interaccionan al mismo nivel en las dos células adyacentes (como cosiéndolas). Las proteÃ−nas de las uniones herméticas son de dos tipos: Claudinas y Ocludinas y tienen una doble función: ♦ Actúan como selladoras del espacio intercelular y evitan que productos de la digestión se pierdan entre dicho espacio intercelular. ♦ Permiten que las proteÃ−nas que estén en dominios distintos (como el apical) no pasen a otros dominios. 2.2) Bandas de adhesión: Está formada por un haz de microfilamentos de actina situados “a modo de cinturón” justo por debajo de la membrana plasmática y justo por debajo de las uniones herméticas en las dos células adyacentes. Además del cinturón, existen unas proteÃ−nas transmembranosas que interaccionan entre si en el espacio intercelular, llamadas Cadherinas. (Fig.2) Las bandas de adhesión permiten o facilitan la adhesión de células diferentes (Fig.3). 2.3) Desmosomas: A diferencia de las bandas de adhesión y las uniones herméticas, los desmosomas actúan puntualmente, no recorriendo toda la célula. Están formadas por dos placas de carácter proteico, una a cada lado de la correspondiente membrana plasmática de la célula, y en las que están ancladas unas proteÃ−nas transmembranosas que interaccionan en el espacio intercelular. Además hay filamentos intermedios de Queratina que conectan todas las placas proteicas que hay en la célula (Fig.4). 2.4) Uniones Comunicantes (nexo o Gap): Están formados por connexones, que a su vez están compuesto por seis subunidades proteicas llamadas conexinas que forman un poro o canal. Son proteÃ−nas transmembranosas y están al mismo nivel con otra célula adyacente, con lo que crean un canal directo de comunicación entre los citoplasmas de las dos células que permite el paso de moléculas pequeñas, iones o nucleótidos (AMPcÃ−clico) (Fig.8). Las uniones comunicantes pueden estar abiertas o cerradas mediante el cambio de configuración de las conexinas. Son uniones muy importantes entre las células de muchos tejidos, no solo epiteliales, sino también por ejemplo las células del músculo liso (contracciones involuntarias). Los connexones no suelen disponerse individualmente, sino en agrupaciones de varios connexones. Tampoco aparecen en ningún otro dominio aparte del lateral. 3) Dominio Basal: 3.1) Hemidesmosomas: 12 Son diferenciaciones de la membrana plasmáticas en la zona basal, presentes en células epiteliales y que permiten la adhesión de la célula epitelial a la lámina basal subyacente. Cada hemidesmosoma está formado por una placa proteica que esta formada por una proteÃ−na llamada plectina, la cual interacciona con integrinas especiales que son proteÃ−nas transmembranosas que por el dominio del medio externo se unen con componentes de la lámina basal Tanto las placas proteicas de los desmosomas del dominio lateral, como los hemidesmosomas del dominio basal están conectados entre si por microfilamentos de queratina (Fig.7). Los hemidesmosomas reciben su nombre debido a que al Microscopio electrónico de transmisión (MET) parecen tener una ultraestructura correspondiente a la mitad de un desmosoma, sin embargo, se ha comprobado que su composición quÃ−mica es completamente diferente (Fig.4). 3.2) Contactos focales (placas de adhesión) Se han estudiado principalmente en los fibroblastos y en cultivo. Son zonas de la membrana plasmática en su parte basal, donde se produce una interacción entre los microfilamentos de actina que estan formando fibras de estrés (rejilla, haz de microfilamentos de actina) en el citosol, y componentes de la matriz extracelular (MEC). Esto se realiza gracias a las integrinas, que de forma indirecta y a través de otras proteÃ−nas interaccionan con los microfilamentos de actina. Un fibroblasto puede organizar y desorganizar estos contactos focales a voluntad, lo que le permite moverse arrastrándose y proyectando pseudópodos. Por tanto están relacionados con la adhesión y el movimiento celulares. Tema 5. Señalización: La señalización es la capacidad que tienen las células para responder a estÃ−mulos del medio externo. Están presentes en las células procariotas, pero son mas complejas en las células eucariotas, especialmente en los mamÃ−feros, donde son fundamentales para el mantenimiento del organismo. Existen moléculas señalizadoras muy diversas: ♦ Hormonas ♦ Factores de crecimiento ♦ Gases (à xido NÃ−trico (NO)) ♦ Neurotransmisores de distinta naturaleza (Tabla 1) Ejemplos: Tiroides (tiroxina), insulina, estradiol, óxido nÃ−trico. Toda célula necesita recibir estÃ−mulos de distinta naturaleza y la respuesta que de, será diferente en base al tipo de estÃ−mulo. Algunos ejemplos de reacciones son la supervivencia, la división, la diferenciación, el movimiento, un cambio del metabolismo, etc. Las células reciben constantemente señales, y el hecho de no recibirlas es causa de que la célula inicie el proceso de suicidio celular (Apoptosis). La célula es capaz de responder a las moléculas señalizadoras (o señal) mediante receptores 13 que se unen especÃ−ficamente a las distintas moléculas señal. Existen dos tipos de receptores para moléculas señal: ♦ Receptores de superficie celular ♦ Receptores intracelulares Una misma molécula señal puede inducir respuestas variables en células distintas. Esto puede deberse debido a que se utilicen distintos receptores, o bien porque estos receptores estén ligados a rutas distintas dentro de la célula. Un ejemplo de esto seria la Acetilcolina, que produce la contracción en el músculo estriado esquelético, mientras que produce la relajación de las células cardÃ−acas y es capaz de inducir la secreción en una célula secretora (Fig.3). De modo general, existen dos tipos de señalización: ♦ Directa (célula-célula) cuando una célula lleva una molécula señal en la membrana plasmática y el receptor está en la membrana plasmática de otra célula. ♦ Por secreción, cuando una célula señalizadora segrega al medio externo moléculas señal hasta que éstas se unen a un receptor en la célula “diana”. Dentro de este último tipo, la señalización puede ser: ♦ Autocrina, cuando una célula produce y segrega una molécula señal que se une a un receptor de la propia célula, lo que ocurre por ejemplo en la respuesta inmune de los linfocitos T. ♦ Paraerina, cuando la molécula señal es liberada al medio externo y actua sobre las células que están en las inmediaciones próximas (Fig.7). ♦ Endocrinas, son moléculas señalizadodas llamadas hormonas, las cuales pasan a la sangre como medio de transporte para llegar a la célula “diana”, por lo que pueden viajar una gran distancia. · Los receptores (Fig.2) Intracelulares: La molécula señal debe ser pequeña e hidrófoba, para que pueda atravesar la membrana plasmática por difusión simple. El receptor de la célula “diana” se localiza en el citosol, o incluso en el núcleo, dependiendo de la naturaleza de la molécula señal. Una vez que la molécula señal se ha unido a su receptor, se activa la transcripción de determinados genes que estaban inactivos y que producen la respuesta celular. à sta consiste en transcribir el ADN en ARN que sale al citosol y sintetiza ProteÃ−nas que luego cumplirán la respuesta deseada. Algunos ejemplos de estas moléculas señal pequeñas (usualmente hormonas) son el Cortisol, el estradiol, la testosterona y la tiroxina (tiroides), entre otros. (Fig.9). Receptores de superficie celular: Responden a moléculas señal hidrofÃ−licas que por tanto no pueden atravesar la bicapa lipÃ−dica y que necesitan un receptor en la superficie celular (Fig.11). Hay tres tipos de receptores de superficie: • Receptores asociados a canales iónicos: La molécula señal se une al receptor de superficie celular de la célula diana, que es un canal regulado por ligando. Y siendo la molécula éste ligando, se abre el canal permitiendo pasar determinados iones (ejemplo de la unión neuromuscular y la acetilcolina.) 14 • Receptores asociados a proteÃ−na G: Son los responsables de muchas funciones del organismo, incluyendo los olores, la vista, el gusto, etc. La molécula señal se une a su receptor en la membrana plasmática y se inicia una cascada de reacciones en el interior de la célula que globalmente recibe el nombre de “transduccion de señales” (Fig.14). C) Receptores asociados a enzimas Dentro de la transducción de señales intervienen distintos tipos de proteÃ−nas, pero también pequeñas moléculas no proteicas llamadas “segundos mensajeros” (AMPc, Ca++, etc). EN la transcripción intervienen proteÃ−nas que actúan como interruptores moleculares para pasar la señal de una proteÃ−na a otra. Es decir, una proteÃ−na que no esta activa pasa a estarlo para pasar una señal. Hay dos tipos diferentes: unas se activan al añadirles un grupo fosfato y se desactivan cuando lo pierden (o viceversa), la otra esta inactivas cuando llevan GDP (Guanosin difosfato) y se activan cuando llevan GTP. (Fig.15). Se llama quinasas a las enzimas que son capaces de unir un grupo fosfato a una proteÃ−na y fosfatasa a aquella enzima que puede quitárselo. (Fig.16). · Proteina G (continuación): Los receptores de membrana asociados a las proteÃ−nas G tienen todos la misma estructura. Son proteÃ−nas transmembranosas que atraviesan 7 veces la bicapa lipÃ−dica con el grupo amino terminal, que es la parte que reconoce a la molécula señal hacia el medio externo. El extremo carboxilo está en el medio interno (Fig.17). Cada proteÃ−na G heterotrimérica está formada por tres subunidades (alfa, beta y gamma). Es una proteÃ−na que esta unida covalentemente a ácidos grasos de la monocapa interna (Fig. 17) y cuando esta inactiva, la subunidad alfa lleva un GDP. Cuando la molécula señal llega a la célula diana, se une al receptor, lo que hace que cambie la conformación del receptor en el dominio que da al citosol, lo que permite que se le una una molécula de proteÃ−na G. Cuando esto sucede, se intercambia el GDP por GTP en la subunidad alfa, y que pasa a ser activa. Por otro lado, se separan la subunidad alfa con el GTP de las subunidades beta-gamma. Una vez activada la proteÃ−na G, se encargará de activar otras proteÃ−nas (Fig.19). La proteÃ−na G activa puede actuar entre otras vÃ−as: ♦ Activar a la adenililciclasa que produce AMPc y se activan PKA (Quinasa A) ♦ Activar a la fosfolipasa C que forma IP3 y DAG que implica la activación de la PKC y un aumento de los iones calcio (Ca++). • Activar la adenililciclasa: La proteÃ−na G activa es capaz de activar al enzima adenililciclasa, que es la encargada de la sÃ−ntesis del AMPciclico a partir de ATP. El AMPc es un segundo mensajero que es capaz de activar a su vez la proteÃ−na Quinasa A (PKA) del siguiente modo: 15 La PKA es un enzima que está inactivo y está formada por dos subunidades catalÃ−ticas y dos subunidades reguladoras. Cuando en una célula se sintetiza AMPc, cuatro moléculas del mismo se unen a la PKA, dos en cada subunidad reguladora. Esto hace que las subunuddades catalÃ−ticas se separen de las subunidades reguladoras, y se encargan de activar otras proteÃ−nas (Figs.20 a 22). • Una proteÃ−na G también puede activar la fosfolipasa C, que es una proteÃ−na periférica de la membrana plasmática, que una vez activada, produce la hidrólisis del fosfatidil-Inositol-Bifosfato (PIP2) en dos moléculas Inositoltrifosfato (IP3) y Diacilglicerol (DAG) (Fig.23 y 24). Tanto el IP3 como el DAG son segundos mensajeros, junto con los iones calcio (Ca++). El IP3 es una molécula soluble que difunde por el citosol y llega hasta la membrana del retÃ−culo endoplasmatico, donde se une a una proteÃ−na de canal controlada por ligando (siendo la IP3 el ligando), con lo que se abre el canal dejando salida a iones calcio (Ca++) almacenados en el, lo que aumenta su cantidad en el citosol. El Diacilgliceral (DAG) permanece integrado en la monocapa interna y a el se le va a asociar la proteÃ−na Quinasa C (PKC, se llama asÃ− porque necesita iones calcio) que junto con iones calcio salidos del RetÃ−culo endoplasmático (RE) activan la PKC que se encargará de fosforilar y activar a otras proteÃ−nas para finalmente producir la respuesta celular. Los iones calcio también pueden actuar activando a una proteÃ−na llamada calmodulina, si a esta se le unen cuatro iones Ca++, lo que cambia su conformación y la capacita para activar otras proteÃ−nas (Fig.23) (Fig. 27) Resumen del tema de señalización. · Tema 6. El Núcleo celular: Es el orgánulo caracterÃ−stico de las células eucariota y su numero y forma es variable según el tipo celular. El núcleo esta rodeado por la envoltura nuclear que rodea la matriz nuclear donde se localiza también la cromatina y el nucleolo. La envoltura nuclear en si misma consta de una membrana nuclear externa (MNE), una membrana nuclear interna (MNI), ambas bicapas lipÃ−dicas, pero también de una estructura laminar formada por filamentos intermedios y situada inmediatamente por debajo de la membrana nuclear interna (MNI). Su función es la de dar sujeción y soporte mecánica al núcleo y además permite interacciones especÃ−ficas con la cromatina. Esta lamina nuclear resulta de la polimerización de unas proteÃ−nas que se llaman láminas nucleares y hay tres tipos (A,B y C). La lámina nuclear solo esta presente cuando la célula esta en Interfase (no se esta dividiendo) y además se interrumpe ante los poros nucleares. Cuando la célula entra en mitosis, la lámina nuclear se fosforila y se desensambla, quedando flotando en el citosol en forma de vesÃ−culas, junto con el resto de la envoltura nuclear (Fig.8 a 12). En la envoltura nuclear también existen los poros nucleares, que son lugares donde se ponen en contacto la membrana nuclear externa (MNE) e Interna (MNI). Son estructuras muy complejas y se han descrito mas de 100 proteÃ−nas distintas que las conforman, junto a las subunidades proteicas de gran tamaño que sobresalen hacia el dominio del citosol. Se calcula que en una célula media hay 16 entre 3000 y 4000 poros nucleares (Fig.1 a 7). · Tipos de cromatina: Al microscopio electrónico de transmisión (MET) se distinguen dos tipos de cromatina: La denominada eucromatina y la heterocromatina. ♦ La eucromatina es una cromatina laxa, que puede transcribirse (esta activa). Y al Microscopio electrónico de transmisión (MET) se ve como zonas poco densas a los electrones en el núcleo y por tanto de color gris. ♦ La heterocromatina es aquella que esta muy condensada y que al Microscopio electrónico de transmisión (MET) aparecen como masas de color negro al ser muy electrodensas. Indican que la cromatina está tan condensada que no puede transcribirse (Fig.12). Se encuentra sobre todo justo por debajo de la envoltura nuclear. Aquellas células que tengan una gran actividad van a tener mucha eucomatina, porque necesitan fabricar muchas proteÃ−nas. Las células embrionarias son un ejemplo muy claro de célula muy activa y que necesita mucha eucromatina para dividirse. Otro ejemplo serian las células cancerigenas. · Tipos de cromatina (continuación): En el tejido conjuntivo hay células (fibroblastos) que tienen gran cantidad de eucromatina ara producir las proteÃ−nas de la matriz extracelular (MEC), las cuales sin embargo se convierten en fibrositos cuando envejecen y se inactivan, transformando su eucromatina en heterocromatina y dejando de estar activos. En el nucleolo se sintetizan los ARN ribosómicos y se ensamblan los ARN mensajeros. Por esto las células activas tienen un nucleolo mas grande que las menos activas. · Transporte nuclear: Las moléculas pequeñas pueden entrar o salir del núcleo atravesando directamente los poros nucleares (Fig.13). Sin embargo, tambien tienen que atravesarlos moléculas grandes como las subunidades ribosómicas (grande y pequeña) o los ARN mensajeros. Para que estos puedan atravesar los poros se requiere un gasto de energÃ−a. Las proteÃ−nas cuyo destino es el núcleo, se sintetizan en los ribosomas libres del citosol, y presentan una determinada secuencia de aminoácidos que se ha llamado “Péptido-señal”, el cual indica a la proteÃ−na que su destino final es el núcleo, actuando a modo de “código postal”. Se han identificado dos secuencias de aminoácidos que le indican a una proteÃ−na recién sintetizada que su destino final es el núcleo (Fig.14). Para el trafico de proteÃ−nas nucleares hacen falta unas proteÃ−nas especiales llamadas importina y exportina, junto con otras proteÃ−nas que se llaman Ran (Fig. 15 y 16). Los cromosomas no están situados al azar en las células, sino que ocupan determinados territorios dentro del núcleo (Fig.17). Cuando una célula esta en interfase (no se esta dividiendo) los cromosomas estan descondensados y se utiliza el término cromatina. Cuando una célula esta en división es cuando se habla de cromosomas o de cromosomas metafásicos. 17 La composición quÃ−mica de la cromatina se divide en ADN y proteÃ−nas (histónicas y no histónicas): ♦ ProteÃ−nas histónicas: Son de tamaño pequeño, que poseen una gran afinidad por el ADN, ya que parte de su secuencia es rica en aminoácidos cargados positivamente, como la lisina y la arginina, con lo que son atraÃ−dos por la carga negativa de los fosfatos del ADN. Las histonas también tienen facilidad para interaccionar entre ellas al interaccionar sus dominios hidrófobos. Las histonas pueden sufrir numerosas modificaciones como “metilaciones” (se les añade un grupo terminal metilo) o “acetilaciones” (se les añade un grupo metilo), que son muy importantes para la regulación. Las histonas son una proteÃ−na muy conservada en la evolución, especialmente la H3 y la H4, lo que significa que tienen secuencias de aminoácidos casi idénticas en especies muy distantes entre si, como la vaca y el guisante, que comparten 108 de los 110 aminoácidos que componen la histona H4. Hay cinco tipos de histonas, la H1, H2A, H2B, H3 y la H4. la función de las mismas es la de compactar, empaquetar el ADN del núcleo. Estas son cambiadas por otras proteÃ−nas llamadas protaminas en el núcleo de los espermatozoides, ya que permiten una mayor compactación del ADN y asÃ− el volumen del núcleo es menor y el espermatozoide es mas aerodinámico. · Niveles de organización de la cromatina: In vivo, el nivel mÃ−nimo de organización esta en la interfase, y el máximo en el cromosoma metafásico. • Nivel: el Nucleosoma: El nucleosoma es la organización que se ve al microscopio electrónico de transmisión (MET) después de tratamientos quÃ−micos y enzimáticos del núcleo para aislar la cromatin y tiene el aspecto de las cuentas de un collar. (Fig. 23) Cada nucleosoma esta formado por una “partÃ−cula núcleo” y un ADN de unión. La partÃ−cula núcleo está formada por un octámero de histonas (un par de H2A, otro de H2B, otro de H3 y uno de H4) y ADN que da una vuelta y ¾ sobre el octámero de histonas, que tiene en si, forma de cilindro (en total 146 pares de bases del ADN son ese giro). El ADN de unión tiene una longitud aproximada de 60 pares de bases, y por ello a veces se dice que el nucleosoma esta compuesto por una partÃ−cula núcleo y 200 pares de bases. • Nivel: Fibra de 10nm: EN este nivel es en el que participa la histona H1, que se situa sobre la partÃ−cula núcleo y hace que se aproximen las “cuentas del collar”. Como cada partÃ−cula núcleo tiene un diámetro de 10nm, este nivel de empaquetamiento recibe el nombre de “Fibra de 10nm”. • Nivel: Fibra de 30nm: Los nucleosomas en hilera, junto con la histona H1 que conforman la fibra de 10nm adoptan una 18 conformación helicoidal de 30nm de diámetro. A este modelo propuesto se le llama modelo del solenoide (Fig.23A) y parece que en las células vivas interfásicas este es el estado en que se encuentra la cromatina. 4. Nivel: Cromosomas metafásicos: Es cuando el ADN consigue el máximo grado de compactación. Cada cromosoma metafasico con dos cromátidas hermanas presenta en el eje central de cada cromátida una estructura proteica a modo de “andamio” sobre la que el ultimo nivel de empaquetamiento se ha apoyado y estas proteÃ−nas del andamio no son histonas. Alrededor de cada eje de andamio la fibra de 30nm se dispone formando una estructura a modo de “mazorca de maÃ−z”, donde cada grano de la mazorca se llama “microcónvula” y el eje central serian las proteÃ−nas no histónicas. Este modelo del cromosoma metafasico se ha propuesto a partir de los experimentos basados en la extracción de las histonas exclusivamente, lo que dejaba ver el andamio no histónico y larguÃ−simos lazos de ADN que entran y salen del mismo. (Fig.28 a 29). Los cromosomas metafasicos se clasifican según el tamaño de sus brazos: ♦ Metacéntricos son aquellos cuyos brazos tienen todos un tamaño similar. ♦ Submetacentricos, cuando uno de los brazos es mas largo que el otro. ♦ Acrocéntricos: La longitud de los brazos es muy desigual ♦ Teloméricos: tienen un solo brazo. Para ver los cromosomas se usa el cariotipo, que es especifico de cada especie. Para ello se necesitan células del organismo que estén en metafase, porque es cuando el ADN está mas condensado y los cromosomas son mas cortos e individualizados. De esta manera se pueden ir emparejando los cromosomas según su forma. El cariotipo sirve además para ver si algún cromosoma es anormal con respecto de los de su especie (Fig.33). · Funciones de la cromatina interfásica: • Replicación: Las células procariotas que no tienen envoltura nuclear realizan todos los procesos en el mismo espacio del citosol. Sin embargo, las células eucariotas tienen núcleo y la replicación y la trascripción la realizan en el nucleolo, mientras que la traducción tiene lugar en el citoplasma. La replicación consiste en obtener dos moléculas de ADN con idéntica información génica entre si y respecto a la molécula inicial, a partir de una sola cadena de ADN. Como cada nueva molécula de ADN se compone de una molécula “nueva” y otra “vieja”, se dice que la replicación es semiconservativa (Fig.3). • Transcripción: Determinadas secuencias de ADN son transcritas a moléculas de ARN, de las que hay 3 tipos de ácidos ribonucleicos: ARN mensajero, ARN ribosómico y ARN transferente, 19 2) Transcripción (continuación): En las células eucariotas existen tres tipos de ARN polimerasas, las cuales intervienen en la transcripción y se denominan ARN polimerasa I, II y III. El producto de la transcripción en la que interviene la ARN polimerasa II es un ARN mensajero. La sÃ−ntesis de este ARN mensajero comienza por el extremo 5' y al poco de iniciarse la transcripción, se le añade una caperuza a ese extremo 5', compuesto por 7 metilguanosina (AAAAAAA). Posteriormente continua la transcripción, la cual finaliza cuando se le añade una cola de poly A. De esta manera se ha sintetizado el precursor del ARN mensajero, denominado también “tránscrito primario” (Fig.5). Una vez que se ha formado el tránscrito primario es necesario que se corten secuencias que no codifican para ningún aminoácido y que se denominan “intrones”. Las otras secuyencias del ARN denominadas exones, se pegan entre si. A este proceso se le denomina “maduración por corte y empalme” (corte y unión). Una vez producida la maduración, el ARNmensajero pasa al citosol a través de los poros nucleares (Fig.7). ♦ La ARN polimerasa I participa en la transcripción del ARN ribosómico, excepto del 5S. ♦ La ARN polimerasa III participa en la transcripción del ARN de transferencia y del ARN ribosómico 5S. La estructura secundaria del ARN trasferente tiene forma de hoja de trébol, en cuyo extremo 3' se le une el correspondiente aminoácido. La estructura terciaria de los ARN trasferentes tiene forma de “L” invertida. Cuando actúa la ARN polimerasa I se forman los ARN ribosómicos, los cuales forman parte de los ribosomas. En los ribosomas eucariotas existen 4 tipos de ARN ribosómico: 28S, 18S, 5,8S y 5S. Estos ARN ribosómicos deben formarse a partir de la actividad de transcripción de la ARN polimerasa I y deben ensamblarse con proteÃ−nas para formar las dos subunidades del ribosoma, todo lo cual ocurre en el nucleolo. En los mamÃ−feros, los genes para el ARN ribosómico están repetidos en varios cromosomas. En la especie humana concretamente, hay 5 cromosomas que contienen esta información (los cromosomas 13, 15, 21 y 22). Esos genes repetidos están separados por secuencias de ADN que no codifican, y se dice que esos genes ribosómicos están en tandem. En los mamÃ−feros, el precursor del ARN ribosómico tiene un tamaño de 45S. Este precursor es modificado al degradarse determinadas secuencias, y los productos finales son un ARN ribosómico 28S, uno 5,8S y uno 18S (Fig. 10). El ARN ribosómico 5S se forma como producto de la transcripción de la ARN polimerasa III y eso ocurre en el núcleo, pero fuera del nucleolo. En resumen, el nucleolo es una estructura esférica no rodeada de membrana, exclusiva de las células eucariotas, donde se están transcribiendo los genes para el ARN ribosómico, exceptuando el 5S, que se forma en el núcleo. Además en el nucleolo se produce el ensamblaje de los ARN ribosómicos con las proteÃ−nas, para formar las subunidades ribosómicas que saldrán al citosol atravesando los poros nucleares. Los genes para ARN ribosómico se encuentran repetidos y separados por secuencias de ADN que no 20 codifican. Cuando varias moléculas de ARN polimerasa I se unen a una de las cadenas de ADN para que se transcriba el gen y se forme el ARN ribosómico 45S, el precursor va creciendo de modo que la imagen al microscopio electrónico de transmisión (MET) de varios de estos genes activos, es la de un “árbol de navidad” (Fig.11). El número de nucleolos en las células es variable, porque muchos de ellos tienen a fusionarse. En cualquier caso, el numero máximo es, en los seres humanos, de 10, ya que habrÃ−a uno por cada cromosoma que los codifica. La transcripción solo tiene lugar en la interfase, y cuando empieza la mitosis, la cromatina se condensa y las polimerasas no pueden actuar, por lo que el nucleolo desaparece (deja de observarse). Existen dos tipos fundamentales de ribosomas, los procariotas y los eucariotas. La función de ambos es la misma, son estructuras celulares en las que se sintetiza proteÃ−nas (Fig.1). Los ribosomas están formados por dos subunidades, que solo están juntas cuando están traduciendo un ARN mensajero, de lo contrario están separados. ♦ Subunidad mayor del ribosoma esta compuesta por ARN ribosómico 5S, 5,8S y 28S ♦ La subunidad menor del ribosoma esta compuesta por ARN ribosómico 18S Ribosoma procariota 70S se compone de 50S (23S, 5S y proteÃ−nas) y 30S (16S y proteÃ−nas). Ribosoma eucariota 80S se compone de 60S y 40S. Un mismo ARN mensajero puede ser traducido por varios ribosomas de forma simultánea, formando polisomas o poliribosomas. Están presentes tanto en eucariotas como en procariotas (Fig.6). de esta forma se sintetizan mas proteÃ−nas en menos tiempo. · Tema 7: El citosol: El citosol es la fase acuosa que rodea y en la que están inmersos los orgánulos. Por el contrario, el citoplasma engloba tanto el citosol como los orgánulos. En el citosol hay una gran cantidad de solutos distintos: ♦ Iones inorgánicos ♦ Intermediarios metabólicos ♦ Hidratos de Carbonos y lÃ−pidos almacenados (glucógeno) ♦ Elevadas concentraciones de proteÃ−na ♦ ARN ♦ Citoesqueleto (microtúbulos, microfilamentos y filamentos intermedios) Además, en el citosol se produce la unión de proteÃ−nas (producidas en un ribosoma libre del citosol (Fig.6)) con lÃ−pidos de la monocapa interna de la membrana plasmática, de lo que se forman las proteÃ−nas periféricas unidas covalentemente a ácidos grasos de la membrana. (ver tema de membranas). En el citosol de muchas células vegetales, especialmente las del parénquima, hay vacuolas con una función múltiple, desde mantener la presión de turgencia, a contener enzimas hidrolÃ−ticos, actuando como los lisosomas de las células animales, hasta a contener sustancias de reserva. A la membrana que rodea las vacuolas se las denomina tonoplastos (Fig7 y 8). · Tráfico de proteÃ−nas: 21 La traducción y la sÃ−ntesis de proteÃ−nas se produce en el citosol y puede seguir dos vÃ−as: ♦ ProteÃ−nas sintetizadas en los ribosomas libres del citosol y cuyo destino final es: 1) el citosol 2) las mitocondrias 3) los cloroplastos 4) el núcleo 5) los peroxisomas ♦ ProteÃ−nas sintetizadas en el RetÃ−culo endoplasmático rugoso (RER) (Fig.1). Las proteÃ−nas de los lisosomas con destino a la membrana plasmática se sintetizan en el RER, pasan al golgi y luego van a sus destinos finales. Los destinos finales son: • RetÃ−culo endoplasmático • Aparato de golgi o destinos posteriores Las proteÃ−nas sintetizadas en los ribosomas saben cual es su destino final porque llevan una secuencia señal. Aquellas proteÃ−nas que no tienen secuencia señal se quedan en el citosol. La secuencia señal suele estar en un extremo de la proteÃ−na, aunque en algunas proteÃ−nas existen varias regiones que en su estructura primaria estan separadas, pero que en la estructura terciaria se encuentran próximas y le van a indicar a la proteina su destino (Fig.3). En la célula existe un ferreo control que asegure que las proteÃ−nas están bien plegadas, ya que si no es asi, éstas tienden a agregarse entre si y pueden causar graves problemas a la célula. Por esto existe un verdadero control de calidad del plegamiento de la proteÃ−na, tanto en las de nueva sÃ−ntesis, como en aquellas que hayan podido desplegarse por lo menos parcialmente por algun tipo de estrés (como un choque térmico) (Fig.4). En la célula existen dos tipos de proteÃ−nas implicadas en facilitar el correcto plegamiento de las proteinas. Una de ellas se denomina chaperonas HSP-70. Se unen a la proteÃ−na conforme está sintetizando en el ribosoma, lo cual requiere gasto de ATP (Fig.5). Las proteÃ−nas que no hayan sido correctamente plegadas después de actuar las HSP-70, son introducidas en unas macroestructuras proteicas (a modo de barril) que se denominan HSP-60 chaperoninas (Fig.6). Si la proteÃ−na no ha quedado correctamente plegada tampoco tras esta fase, pasará a degradarse en el proteasoma, que es un complejo macromolecular situado en el citosol y es una “maquinaria” que le permite a la célula degradar en péptidos pequeños (7 a 10 aminoácidos) las proteÃ−nas mal plegadas y/o aquellas que hayan finalizado su actividad. Para saber que una proteÃ−na tiene que ser degradada por el protasoma, es necesario que esa proteÃ−na vaya marcada por varios resudios de una pequeña proteÃ−na muy conservada en la evolución, llamada ubiquitina (Fig. 8). Solo se degradan aquellas proteÃ−nas que lleven unidas varios residuos de ubiquitina. En el citosol, tenemos varios proteasomas. Estas macroestructuras estan formadas por una cámara central que es donde se rompen (hidroliza) la proteÃ−na que se está degradando, y unas antecámaras a cada lado de la misma. Son estructuras tan grandes que se pueden visualizar al microscopio electrónico de transmisión (MET). (Fig.7). 22 Tema 8: RetÃ−culo endoplasmático: El RetÃ−culo endoplasmático (RE) está formado por una serie de cisternas membranosas, que se continuan con la membrana nuclear externa. Si llevan adheridos ribosomas, se habla de RetÃ−culo endoplasmático rugoso (RER), de lo contrario se denomina retÃ−culo endoplasmático liso (REL). Las membranas del retÃ−culo endoplasmático liso (REL) son la continuación del retÃ−culo endoplasmático rugoso (RER), y en lugar de cisternas aplanadas, la membrana del retÃ−culo liso (REL) forma estructuras tubulares (Fig.7). EL retÃ−culo endoplasmatico rugoso puede observarse al microscopio electrónico de transmisión (MET) (Fig.2) y también puede obtenerse por centrifugación de la fracción donde se acumulan vesÃ−culas formadas a partir del retÃ−culo endoplasmático rugoso y liso (RER y REL) y que se denominan microsomas (Fig.3 y 4). En el citosol existe un conjunto común de subunidades ribosómicas (separadas). Estas se asocian y traducen un ARN mensajero, formándose una proteÃ−na por parte de usos ribosomas libres del citosol. Sin embargo, otra parte de los ribosomas que van a traducir ARN mensajero se asocian con el RetÃ−culo endoplasmático rugoso (RER), donde finalizan la traducción. · Funciones del retÃ−culo endoplasmático rugoso (RER): • SÃ−ntesis de proteÃ−nas: ♦ ProteÃ−nas de Secreción ♦ ProteÃ−nas integrales de la membrana plasmática ♦ ProteÃ−nas periféricas de la monocapa externa de la membrana plasmática ♦ ProteÃ−nas de los lisosomas ♦ ProteÃ−nas del aparato de Golgi ♦ ProteÃ−nas del RetÃ−culo endoplasmático (RE) En el proceso participa la “partÃ−cula de reconocimiento de la señal” (PRS), formada por seis proteÃ−nas y una pequeña molécula de ARN (Fig.6). Cuando una proteÃ−na que se está sintetizando en los ribosomas libres del citosol tiene una determinada secuencia señal en su extremo amino terminal, se le une inmediatamente la partÃ−cula de reconocimiento de la señal (PRS). La traducción del ARN mensajero se detiene y el ribosoma se desplaza a la membrana del retÃ−culo endoplasmñatico rugoso (RER), donde interacciona con un receptor de la partÃ−cula del PRS y con un translocador transmembranoso. El ribosoma se asocia al retÃ−culo endoplasmico rugoso (RER) por su subunidad mayor. A continuación, la partÃ−cula de reconocimiento de la señal (PRS) se separa del ribosoma y comienza la translocación, que es el paso de la proteÃ−na al retÃ−culo endoplasmatico. Luego se reanuda la traducción y un enzima del retÃ−culo llamada “señal peptidasa” hidroliza el péptido señal de la proteÃ−na, con lo que esta cae a la luz del retÃ−culo (Fig.8). No todas las proteÃ−nas sintetizadas en el RetÃ−culo endoplasmico rugoso (RER) caen a la luz del retÃ−culo. Utilizando diferentes secuencias de aminoácidos que hay en la proteÃ−na, también es posible que la proteÃ−na quede como una proteÃ−na transmembranosa de paso único o múltiple de la membrana del retÃ−culo endoplasmático rugoso (RER) (Fig.10). El grupo terminal amino y carboxilo pueden dar 23 hacia el interior o hacia el exterior indistintamente. 2) Glicosilación de proteÃ−nas: Todas las proteÃ−nas sintetizadas en el RetÃ−culo endoplasmatico rugoso (RER) suelen estar glicosiladas (son glicoproteÃ−nas). No ocurre lo mismo con la gran mayorÃ−a de las proteÃ−nas que se sintetizan en los ribosomas libres del citosol. Conforme se esta sintetizando la proteÃ−na en el retÃ−culo y aparece un residuo del aminoácido “asparagina” (en una determinada secuencia), se le une a éste (por un grupo amino que posee), un hidrato de carbono pequeño (Oligosacárido) preformado, que consta de 2 residuos de N-acetilglucosamino, 9 residuos de manosa y 3 residuos de glucosa. à ste oligosacárido suele estar unido al Dolicol, que es un lÃ−pido de la membrana del retÃ−culo endoplasmatico rugoso (RER) (Fig.11). Este oligosacárido se va modificando, y su modificación comienza en el propio retÃ−culo endoplasmatico (RER) y luego continua en el aparato de Golgi. 3) SÃ−ntesis de proteÃ−na anclados a la membrana por un glicosilfosfatidilinositol Hay proteÃ−nas que se sintetizan en el RetÃ−culo endoplasmatico rugoso (RER) que tienen una determinada secuencia de aminoácidos en el extremo carboxilo terminal, que les hace quedarse inmersos por esta secuencia en la membrana del retÃ−culo. En el retÃ−culo endoplasmatico rugoso existe un enzima que se encarga de hidrolizar esa secuencia y de anclar el resto de la proteÃ−na a un glicolÃ−pido de la membrana del retÃ−culo, en la monocapa interna (Fig.13). 4) Formación de puentes de disulfuro en las proteÃ−nas que se sintetizan en el retÃ−culo endoplasmico rugoso (RER), ya que poseen el enzima disulfuroisomerasa, necesario para que se formen los puentes disulfuro correctos en la proteÃ−na que se acaba de sintetizar. 5) Correcto plegamiento de las proteÃ−nas que se han sintetizado en el RetÃ−culo endoplasmico rugoso (RER). En el interior del retÃ−culo también hay unas proteÃ−nas que ayudan al correcto plegamiento de las proteÃ−nas y que se llama BiP. · El RetÃ−culo Endoplasmatico Liso (REL): Funciones del retÃ−culo endoplasmatico Liso (REL): ♦ SÃ−ntesis de fosfolÃ−pidos: Los enzimas que participan en las rutas de sÃ−ntesis de los fosfolÃ−pidos se localizan muchas de ellas en las membranas del RetÃ−culo endoplasmatico Liso (REL). El resto de las rutas tiene lugar en el citosol (Fig.15). La fosfatidilcolina por ejemplo, queda al final de su proceso de sÃ−ntesis en la monocapa externa de la membrana del retÃ−culo. Por tanto, todos los fosfolÃ−pidos de nueva sÃ−ntesis quedan incorporados en la monocapa citosolica, lo cual crearia un crecimiento anormal entre las dos monocapas. Un enzima llamado flipasa se encarga de reequilibrar ambas monocapas dándoles la vuelta a algunos fosfolÃ−pidos (Fig.16). Una vez formados los nuevos fosfolÃ−pidos del retÃ−culo endoplasmatico liso (REL), se 24 desprenden de este unas vesÃ−culas (que están hechas de fosfolÃ−pidos en su capa) que se fusionarán con otros orgánulos, aportándoles nuevos fosfolÃ−pidos. Sin embargo, no todos los orgánulos celulares admiten la fusión de vesÃ−culas, asÃ− por ejemplo las mitocondrias y los cloroplastos necesitan de una proteÃ−na que se encargue de unir los fosfolÃ−pidos uno a uno e insertarlos en su membrana (Fig.17). ♦ SÃ−ntesis del colesterol y sus derivados (hormonas esteroideas): Las células especializadas en la sÃ−ntesis de este tipo de hormonas tienen un retÃ−culo endoplasmico liso (REL) muy desarrollado. Además de esta ruta interna de sÃ−ntesis de colesterol en el retÃ−culo endoplasmatico liso (REL), las células toman colesterol del medio externo gracias a la endocitosis mediada por receptor para partÃ−culas LDL. ♦ Detoxificación: Eliminación de sustancias que en caso de acumularse, serian toxicas y que por tanto hay que eliminar del organismo. Por esta razón, las células del hÃ−gado (hepatocitos) suelen tener muy desarrollado el retÃ−culo endoplasmico liso (REL) incluyendo enzimas como el citocromo P450 que hace soluble en agua los productos tóxicos. De esta forma se eliminan a través de la bilis. Cuando una persona está sometida a un tratamiento con barbitúricos, los hepatocitos desarrollan mas retÃ−culo endoplasmatico liso (REL) para eliminarlos, y cuando el paciente deja de tomarlos, los hepatocitos vuelven a su tamaño normal. 4) En el RetÃ−culo endoplasmatico liso (REL) se almacenan también iones calcio.(Ca++). Esta función es especialmente importante en las células musculares, ya que la salida de los iones calcio (Ca++) desde el retÃ−culo endoplasmatico liso (REL) de estas células induce a la contracción muscular (Fig.18). · El aparato de Golgi El aparato de golgi esta constituido por un conjunto de cisternas aplanadas de bordes dilatados, yun conjunto de vesÃ−culas próximas al mismo. A veces también es denominado Dictiosoma, el aparato de golgi se localiza próximo al núcleo y en hay una clara polaridad. La cara cis (o de entrada) es la que queda enfrentada y mas próxima al retÃ−culo, mientras que la cara trans (o de salida) queda en el extremo opuesto (Fig.2). Desde el retÃ−culo y desde el golgi va a haber un transporte de vesÃ−culas que se forman por dilataciones de la membrana del orgánulo donante, que se mueven por el citosol y se fusionan con la membrana del orgánulo diana. · Estructura del aparato de golgi La red del cis golgi es donde llegan vesÃ−culas prodecentes del retÃ−culo. Luego se sitúa la cisterna cis, seguida por la cisterna medial o media, la cisterna trans y finalmente la red del trans golgi, de donde se desprenden vesÃ−culas hacia sus destinos finales (Fig.4). Existe una denominada ruta anterograda (que va hacia delante), y es aquella en la que vesÃ−culas con su correspondiente contenido, salen del retÃ−culo y llegan al golgi. Pero tambien existe una ruta retrograda (de retorno), por la cual se desprenden vesÃ−culas del aparato de golgi y vuelven al retÃ−culo, porque es ahÃ− donde funcionan las moléculas que contienen. Esta vÃ−a de retorno se realiza mediante receptores (Fig.6), que son proteÃ−nas transmembranosas que reconocen especÃ−ficamente a las proteÃ−nas residentes 25 en el retÃ−culo y se encargan de llevarlas de vuelta a este orgánulo. Hasta hace poco, el modelo de funcionamiento del aparato de golgi era el del modelo de transporte vesicular: Según este, vesÃ−culas llegadas del retÃ−culo pasaban a través del golgi mediante vesÃ−culas, y salÃ−an por la cara trans, también mediante vesÃ−culas. Hoy en dÃ−a sin embargo, este modelo ya no es aceptado (Fig.7), ya que según el, las cisternas serian fijas e inamovibles, y las moléculas pasarÃ−an de una a otra por vesÃ−culas. Actualmente, el modelo aceptado es el modelo de maduración de cisternas. Según este, las cisternas van madurando, formadas a partir de vesÃ−culas del retÃ−culo. Estas van convirtiéndose en la cisterna cis, luego en la cisterna medial, en la trans, y finalmente se vuelve a separar, formando la red trans golgi, para luego repartirse hacia sus destinos finales. Este modelo sostiene pues que las cisternas siempre cambian, generándose a partir de las vesÃ−culas que recibe del retÃ−culo. Es importante especificar que la ruta de retorno para proteÃ−nas del retÃ−culo esta inalterada en el modelo de maduración de cisternas. Las vesÃ−culas que recibe el golgi provienen del retÃ−culo endoplasmatico rugoso (RER), concretamente de una parte pequeña y especifica llamada “retÃ−culo de tansición” que esta justo en frente de la cara cis del golgi y en la que no hay ribosomas. ·Funciones del aparato de golgi ♦ Modificación de los oligosacáridos N-ligados a proteÃ−nas: Los oligosacáridos N-ligados se han formado en el RetÃ−culo endoplasmico rugoso (RER) y el oligosacarido es siempre el mismo, conformado por 3 glucosas, 9 manosas y dos residuos de n-acetil glucosamina. Este oligosacarido unido a la proteÃ−na comienza su procesamiento en el propio retÃ−culo y continua procesándose en el aparato de golgi (Fig.8). En el retÃ−culo se eliminan los 3 residuos de glucosa y una manosa, y cuando esa proteÃ−na llega al aparato de golgi, continúa el procesamiento del oligosacarido que lleva unido (Fig.9). En el golgi el oligosacarido pasa 6 estadios en los que es modificado: ♦ En el retÃ−culo pierde 3 glucosas y una manosa ♦ Se eliminan 3 residuos de manosa ♦ Se añade un residuo de n-acetil glucosamina ♦ Se quitan 2 residuos de manosa mas ♦ Se añaden otros 3 residuos de n-acetil glucosamina y un residuo de “fucosa” ♦ Se añaden 3 residuos de galactosa ♦ Se añaden 3 residuos de ácido sialico (nanas), que estan cargadas negaticamente. A partir del paso 6, el hidrato de carbono pasa a llamarse “oligosacarido N-ligado complejo”, formado por 15 hidratos de carbono: 3 manosas, 5 n-acetil glucosaminas, una “fucosa”, 3 galactosas y 3 ácidos siálicos. ♦ Formación de los oligosacaridos O-ligados En el aparato de golgi se le añaden hidratos de carbonos a las proteÃ−nas que pasan por el, en concreto a residuos del aminoácido “serina”, y por eso se llaman oligosacaridos O-ligados, ya que se unen a través de un oxÃ−geno del OH original. ♦ Clasificación previa de las proteÃ−nas para sus destinos finales. Los destinos finales de las 26 proteÃ−nas que pasan por el Golgi son lisosomas, la membrana plasmática y la secreción de vesÃ−culas (Fig.10). Los enzimas que actúan en el Golgi tienen una determinada distribución dentro de este orgánulo, es decir, no están todas mezcladas en todos los compartimentos. Por ejemplo, los enzimas que eliminan manosas de los N-ligados complejos se localizan en la cisterna cis y en la medial. Los enzimas que añaden galactosa y nana. En la red del trans golgi se produce la clasificación de las distintas vesÃ−culas con contenidos adecuados para que lleguen a sus destinos finales. Los enzimas (que son hidrolasas) que contienen los lisosomas se sintetizan en el RER y mediante vesÃ−culas llegan al Golgi y en la red del cis Golgi son marcados mediante la unión de un fosfato a un residuo de manosa (manosa - 6 -P). Este enzima asÃ− modificado atraviesa los distintos compartimentos y una vez en la red trans golgi es reconocido por un receptor de membrana que hay en esta pared del golgi que reconoce exclusivamente la m6o que lleva el enzima del lisosoma. De la red del trans golgi se desprende una vesÃ−cula recubierta de clatrina que poco después se pierde y se va juntando con otras vesÃ−culas, formándose asi el lisosoma, en cuyo interior se elimina el fosfato y el receptor se recicla volviendo al Golgi mediante vesÃ−culas, quedando un lisosoma que contiene hidrolasas maduros (Fig.12). La unión del fosfato al residuo de manosa se produce porque el enzima encargado de ello reconoce una determinada región señal en la proteÃ−na lisosomica. (Fig.13) Además de tener como destino el formar un lisosoma, las proteÃ−nas localizadas en la red del trans golgi tienen otros destinos que son englobados en la denominada secreción. Existen dos tipos de secreción: ♦ la vÃ−a constitutiva, que la realizan todas las células del organismo constante mente, de forma que vesÃ−culas desprendidas del golgi alcancen la membrana plasmática, se fundan con ella incorporando la membrana de la vesÃ−cula a la membrana plasmática y liberando el contenido al medio externo (Fig. 14). ♦ VÃ−a regulada, que no la tienen todas las células, sino solo aquellas especializadas en la secreción de alguna proteÃ−na. No se realiza constantemente la fusión con la membrana plasmática, sino que la vesÃ−cula se desprende del golgi y a continuación se queda en el citosol hasta que la membrana plasmática de la célula le llegue una señal. Entonces es cuando se produce la secreción. Todas las células especializadas en la secreción de algún tipo de proteÃ−na, realizan la misma ruta intracelular. La proteÃ−na se sintetiza en el retÃ−culo endoplasmático rugoso (RER), llega al aparato de golgi y del golgi se desprenden vesÃ−culas conteniendo esa proteÃ−na. La rusa de secreción se ha podido comprobar con el uso de partÃ−culas marcadas radiactivamente (Fig.17). El tráfico de vesÃ−culas en el citosol depende de las proteÃ−nas que recubran las vesÃ−culas. De esta forma se pueden controlar los destinos finales de las mismas. Hay tres tipos de proteÃ−na que recubre las vesÃ−culas: ◊ COPI: Están implicados en el transporte retrógrado en el aparato de golgi y del Golgi al retÃ−culo. ◊ COPII: Rodea vesÃ−culas que se desprenden del retÃ−culo y llegan a la red del cis-golgi. ◊ CLATRINA: Rodea vesÃ−culas que van de la red trans-Golgi a formar un lisosoma, 27 y en aquellas vesÃ−culas implicadas en la endocitosis mediada por receptor. Hoy en dÃ−a (2007) las vesÃ−culas de la vÃ−a secretora (constitutiva y regulada) no esta claro que proteÃ−nas recubren esas vesÃ−culas. · Tema 12: Lisosomas y Peroxisomas Los lisosomas son orgánulos rodeados de una membrana que se caracteriza por contener enzimas hidrolÃ−tico (hidrolasas) en su interior. El PH en el interior de un lisosoma es ácido (5), cuando en el citosol es de 7 o 7,2. Esta acidez se consigue porque en la membrana del lisosoma se encuentran unas bombas de protones que permiten una acumulación de los mismos. Las bombas requieren un gasto de energÃ−a en forma de ATP para funcionar. Las hidrolasas ácidas que contienen los lisosomas son de muy distinta naturaleza t capaces de degradar cualquier sustrato celular (Fig. 1 y 2). De todas las enzimas que contienen los lisosomas, hay una, la fosfatasa ácida, que al ser caracterÃ−stica exclusiva de los lisosomas, suele utilizarse para identificar este orgánulo mediante una serie de reactivos. Los lisosomas se encargan de degradar moléculas y microorganismos, e incluso orgánulos propios por distintas vÃ−as (Fig.3): ◊ Fagocitosis: Solo la realizan unas pocas células del organismo (Neutrófilos y macrófagos. El microorganismo queda rodeado por una membrana que procederá de la membrana plasmática, formándose el fagosoma, que al fusionarse con el lisosoma, degrada al microorganismo. ◊ Endocitosis: La membrana plasmática se invagina, englobando partÃ−culas del medio, se forma una vesÃ−cula en el citosol que se fusiona con un lisosoma para ser hidrolizadas. ◊ Autofagia: Se produce para renovar los propios orgánulos de la célula y también en casos de necesidad extrema, cuando la célula no le llegan metabolitos energéticos. En la autofagia, un repliegue doble de membrana del retÃ−culo endoplasmático liso engloba los orgánulos, formando el autofagosoma que se fusiona con el lisosoma y degrada el orgánulo (Fig.6). · Los peroxisomas: Son los últimos orgánulos descubiertos en la célula eucariota. Al igual que los lisosomas, son redondeados, recubiertos de membrana y presentes en las células animales y vegetales. Contienen distintos tipos de enzimas oxidativos, siendo la catalasa el enzima caracterÃ−stico. En el interior de los peroxisomas se dan numerosas reacciones de oxidación, formando peroxido de hidrógeno (H2O2 o Agua oxigenada), que puede resultar tóxicos en grandes cantidades, por lo que son degradadas por la celulasa en agua y oxÃ−geno. Los peroxisomas son especialmente abundantes en las células del hÃ−gado en muchas especies, excepto en la especie humana. Presenta al MET en su interior una especie de estructura cristalina electrodensa (Fig.1 a 3). 28 · Los Peroxisomas (continuación): En las células de las semillas en germinación, existen unos peroxisomas especiales que se llaman glioxisomas, que intervienen en la transformación de las grasas acumuladas en las semillas en hidratos de carbono. Esta ruta es exclusiva de estos orgánulos y por tanto de esas células. Los enzimas que contienen los perxisomas son sintetizados en los ribosomas libres del citosol y poseen en su extremo carboxilo una secuencia de 3 aminoácidos que es reconocida por un receptor llamado Pex5 que hay en el citosol, y que lleva la enzima hasta la membrana del peroxisoma, donde hay otro receptor y finalmente pasa a través de la bicapa lipÃ−dica del peroxisoma por un translocador complejo multiprotéico hasta la matriz (Fig.4). · Biogénesis (creación de un orgánulo) del peroxisoma: Hasta hace muy poco, la única teorÃ−a admitida era que todo peroxisoma procedÃ−a de un peroxisoma anterior que crecÃ−a y se dividÃ−a en dos. Hoy en dÃ−a se admite que también se pueden formar peroxisomas “de novo” aunque el mecanismo no esta completamente estudiado. En este nuevo modelo, una membrana precursora procedente del retÃ−culo endoplasmático primero incorpora las proteÃ−nas de la matriz y se forma un peroxisoma “fantasma” al que posteriormente se le unen las enzimas caracterÃ−sticas de los mismos, como las catalasas, formándose el peroxisoma maduro (Fig.4). · Tema 13. La mitocondria Son orgánulos alargados del tamaño de una bacteria. Son el centro energético de la misma, ya que en ellas se sintetiza el ATP, y se caracterizan por la siguiente estructura: ◊ Membrana mitocondrial externa (MME): Es una membrana muy permeable que contiene gran cantidad de una proteÃ−na llamada porina, que forma pasos por los que dejan pasar muchas moléculas, pero no si están cargadas positivamente. ◊ Membrana mitocondrial interna (MMI): Es muy poco permeable y se caracteriza por no tener colesterol, y si una proporcion muy grande de proteÃ−nas . Esta membrana hace una gran cantidad de repliegues llamados Crestas mitocondriales, que en muchos casos son perpendiculares al eje mayor de la mitocondria. ◊ Matriz mitocondrial: Contiene gran número de enzimas (del ciclo de Krebs, de la beta-oxidación de los ácidos grasos). Parte de la beta oxidación de los ácidos grasos también ocurre en los peroxisomas, aproximadamente el 25%. En la matriz mitocondrial también hay ADN mitocondrial. Suele haber varias moléculas, dobles y circulares, y que no están asociados a histonas (proteÃ−nas). También hay ribosomas que son distintos de los del citosol, pues se parecen mas a los ribosomas de las células procariotas. Gran parte de las proteÃ−nas de las mitocondrias las sintetizan los ribosomas libres del citosol, y tienen que ser importadas hasta la mitocondria. El resto de las proteÃ−nas de la mitocondria están codificadas por el ADN mitocondrial, y se sintetizan en los ribosomas mitocondriales que hay en la matriz mitocondrial (Fig.7). El código genético que es universal para los seres vivos, esta alterado en las mitocondrias, de modo que algunos tripletes o codones codifican de forma diferente (Fig.8). Toda mitocondria procede de una mitocondria anterior, que crece y se divide en dos 29 (Biogénesis) (Fig.9), además se ha comprobado que en las células vivas las mitocondrias sufren continuamente procesos de fusión y de fisión (Fig.10). Cuando una célula entra en apoptosis (se suicida) en muchos casos se procede la salida del citocromo c desde el espacio intermembrana hasta el citosol, desencadenándose la vÃ−a de señalización desde la mitocondria, que induce a la apoptosis. ·Importacion de proteÃ−nas del citosol a la mitocondria: Las proteÃ−nas mitocondriales sintetizadas en los ribosomas libres del citosol llevan unidas proteÃ−nas HSP-70 chaperoninas, que impiden que la proteÃ−na se pliegue. Además esas proteÃ−nas tienen una determinada secuencia aminoterminal que es reconocida por un receptor que hay en la membrana mitocondrial externa (MME) y que forma parte de un complejo translocador denominado TOM. Una vez reconocida la proteÃ−na, esta atraviesa el complejo TOM y a continuación encuentra un segundo complejo translocador situado en la membrana mitocondrial interna (MMI) llamado TIM23. Conforme la proteÃ−na asoma por la matriz mitocondrial, se le unen proteÃ−nas HSP-70 chaperoninas mitocondriales, ayudando a que la proteÃ−na acabe en la matriz mitocondrial. Un enzima de la matriz se encarga de eliminar el péptido señal. Además de la participación de la HSP-70 citosolica y mitocondriales, es fundamental la acción del gradiente electroquÃ−mico del espacio Inter.-membrana (Fig.12). Esta translocación tiene lugar en puntos donde las dos membranas mitocondriales están muy próximas. El origen endosimbiontico de la mitocondria viene de cuando fue fagocitada por una célula eucariota y parte de los genes pasaron desde el organismo procariota al núcleo. En la fecundación de mamÃ−feros, todas las mitocondrias son aportadas por el óvulo. · Tema 14: Los Plastidios Son orgánulos exclusivos de la célula vegetal, relacionados con procesos metabólicos, de sÃ−ntesis y de almacenamiento de sustancias. Hay diversos tipos, y todos tienen en común una doble membrana: ♦ Blastidios Indiferenciados: ◊ Proplastos: Son los blastidios inmaduros de los cuales se originan todos los demás. Tienen forma redondeada y un tamaño menor al resto. Poseen ribosomas, alguna laminilla y algún grano de almidón. Están presentes en las células del meristemo de las raÃ−ces. En presencia de luz los proplastos del parénquima se transforman en Cloroplastos (Fig.1A). ◊ Etioplastos: Preceden de los proplastos, que se diferencian en la oscuridad. Tienen estructuras tubulares que se organizan en estructuras cristalinas y que se denominan “cuerpos prolamenares”, visibles al microscopio electrónico de transmisión (MET) (Fig.2). ◊ Blastidios diferenciados: ⋅ Cloroplastos: Son fotosinteticamente activos y son el centro energético de las células vegetales. ⋅ Cromoplastos: Son orgánulos no fotosintéticos y tienen pigmentacion (betacaroteno, etc). 30 ⋅ Leucoplastos: Incoloros, no son fotosinteticamente activos, almacenan distintas sustancias, como el almidón (Amiloplastos) o proteÃ−nas (protenoplastos), etc (Fig.1B). · Los Cloroplastos: Los cloroplastos realizan la fotosÃ−ntesis mediante la clorofila, y su número es variable según el tejido vegetal, siendo especialmente abundantes en el parénquima clorofÃ−lico (de 30 a 40 cloroplastos). Los cloroplastoso tienen forma ovalada en las plantas superiores. De las dos membranas que los recubren, la externa tiene porinas y es por tanto bastante permeable, mientras que la interna es poco permeable. Entre ambas se encuentra el espacio Inter.-membrana. La membrana interna del cloroplasto rodea el estroma, que es la matriz del cloroplasto. En el estroma hay una tercera membrana en forma de laminillas o sacos, llamados tilacoides los cuales están orientados longitudinalmente en el orgánulo. En el estroma también hay ribosomas del cloroplasto, casi idénticos a los ribosomas procariotas. Al igual que la mitocondria, el ADN del cloroplasto es doble y circular, y no esta asociado a proteÃ−nas. Finalmente, en el estroma hay gran cantidad de enzimas. · Los Cloroplastos (continuación): Las moléculas (Fotosistemas 1 y 2, cadena transportadora de electrones y ATP sintetasa) se encuentran en la membrana de los tilacoides. La porción esférica de la ATP sintetasa está orientada hacia el estroma y durante el transporte de electrones hay un flujo de protones que se almacenan en la luz del tilacoide, creando un gradiente electroquÃ−mico, tal y como lo hacen las mitocondrias en el espacio Inter.-membrana (Fig. 4 a 7). El Cloroplasto tiene un origen endosimbionte, igual que las mitocondrias, con las que tienen mucho en común. Parte de las proteÃ−nas del cloroplasto se sintetizan en los ribosomas del estroma, sin embargo la gran mayorÃ−a se sintetizan en los ribosomas libres del citosol. Esas proteÃ−nas poseen unos determinadas secuencias señal, que les indican cual es su destino final en el cloroplasto. En las membranas existen translocadores adecuados para que puedan atravesar las correspondientes membranas (Fig.9). · Tema 16: Los microtúbulos: · Introducción al citoesqueleto: El citoesqueleto es toda una serie de redes y estructuras de naturaleza proteica que actúan formando una suerte de esqueleto dentro de la célula. Se encuentra en el citosol y es exclusivo de las células eucariota. 31 El citoesqueleto realiza una función dinámica en la mayorÃ−a de los casos, pudiendo ensamblarse y desensamblarse en poco tiempo. También realiza funciones tan importantes en la célula como el mantenimiento de la forma de la misma, la separación de los cromosomas durante la mitosis, la disposición de los orgánulos en el citosol, y tambien intervienen en la locomoción de la célula. Todas estas funciones se realizan en todos los tipos celulares, aunque las células musculares tienen mas desarrollado el citoesqueleto porque interviene en la contracción de la misma. Hay tres componentes del citoesqueleto: • Los Microtubulos (MTs): Diámetro 25nm y hueco por dentro • Los Microfilamentos (MFs) de actina, de 8nm de diámetro • Los Filamentos Intermedios (FIs) compuestos de gran variedad de proteÃ−nas y de 10nm de diámetro. • · Estructura de los Microtubulos: • Los microtúbulos están formados por la polimerización (ensamblaje) de la molécula de una proteÃ−na llamada tubulina. Cada molécula de tubulina es un heterodÃ−mero porque esta formado por una molécula de tubulina alfa y otra beta que no se disocian. Cada subunidad de la molécula de tubulina tiene unida una molécula de GTP (Guanosin trifosfato) cuando esta como monómero (no ensamblado). La GTP que lleva la subunidad alfa nunca se hidroliza pero el de la subunidad beta se hidroliza al poco después de que se haya ensamblado en un microtúbulos. La hidrólisis hace que pase a GDP (Fig.1). • Cada Microtubulo (MT) está formado por 13 protofilamentos que se disponen formando un cilindro hueco de unos 25 nanometros de diámetro. Cada protofilamento resulta de la alineación perfectamente ordenada de moléculas de tubulina (Fig.2). • En experimetos “in Vitro” pueden formarse microtúbulos y se ha comprobado que esos microtúbulos presentan una polaridad estructural. Todos tienen un extremo + y un extremo -. • El extremo + está formado por un anillo de beta-tubulina y el extremo - por un anillo de alfa-tubulina. Tambien en experimentos “in Vitro” se ha comprobado que los dos extremos del microtúbulos tienen distinta velocidad de ensamblaje y desensamblaje, siendo la mayor en el extremo + con respecto al extremo - (Fig.4). Los microtúbulos además de tubulina suelen tener asociados proteÃ−nas que resultan fundamentales para sus funciones. Se denominan proteÃ−nas asociadas a los microtúbulos (MTs), como lo son la MAP2 o la proteÃ−na Tau, que se localizan en los Microtubulos (MTs) que hay en las neuronas (Fig.3). • Tau es una proteÃ−na que se encuentra alterada porque esta hiperfosforilada en lo pacientes de la enfermedad de Alzheimer. Esta forsforilacion hace que los microtúbulos (MTs) de estas neuronas se vuelvan inestables, y que la proteÃ−na Tau se deposite en las neuronas, formando unas estructuras caracteristicas en forma de “ovllos” en esos pacientes. Al final la neurona acaba muriendo por esos depositos de proteÃ−na Tau. • 32 • Los estudios “in Vitro” han demostrado que los Microtubulos (MTs) se ensamblan siguiendo una serie de pasos o etapas (Fig.5). • Todos los microtúbulos que hay en una célula poseen un centro organizador de microtúbulos (COMTs). En una célula en interfase (que no se esta dividiendo) el centro organizador de los microtúbulos (COMTs) interfasicos es el centrosoma. En una célula con cilios o flagelos, que estan formados por microtúbulos (MTs), tienen en su base un centro organizador de microtúbulos (COMTs) que se llama “cuerpo basal” o “cinetosoma”. En una célula mitótica que tiene desorganizados los microtúbulos (MTs) interfásicos, organiza el huso mitótico y cada uno de los dos polos del huso es un centro organizador de dicho huso. En una neurona donde también hay muchos microtúbulos (MTs), el centro organizador (COMTs) es también el centrosoma. En todos los casos, el extremo - de los microtúbulos (MTs) es el mas cercano al centro organizador (COMTs) y el extremo + el mas alejado del mismo (Fig.6). En una célula interfasica, parten del centrosoma a modo de radios, los microtúbulos (MTs) interfasicos hasta el limite de la célula. Ese centrosoma se localiza próximo al núcleo y está formado por un par de centrÃ−olos en disposición perpendicular, y un material pericentriolar alrededor de los centrÃ−olos, formado por una proteÃ−na llamada “pericentrina” y unos anillos de gamma-tubulina que se ha comprobado que sirven como lugares de nucleación, de modo que a partir de ellos van creciendo (parten) los microtúbulos (MTs). En las células vivas se ha comprobado que los microtúbulos (MTs) interfasicos se caracterizan por la denominada “inestabilidad dinámica”. Es decir, un microtúbulos (MTs) determinado crece y decrece de forma contÃ−nua. No tienen por tanto una longitud fija ni constante (Fig.8). Cuando un microtúbulos (MTs) deja de crecer, se utiliza el termino “catástrofe” y en el momento que deja de acortarse y vuelven a crecer, se denomina “rescate”. Cuando el microtúbulos (MTs) se desensambla se obtienen imágenes al microscopio electrónico de transmisión (MET) a modo de palmeras. El acortamiento y alargamiento de los microtúbulos (MTs) en una célula se produce por el extremo + y se ve en forma de “palmera”. · Funciones de los microtúbulos (MTs): ⋅ Forma celular ⋅ Separación de los cromosomas ⋅ Transporte intracelular de vesÃ−culas y orgánulos: Los microtúbulos actúan como carriles por donde se mueven vesÃ−culas rodeadas de membrana y orgánulos. Esto se consigue gracias a las proteÃ−nas asociadas a los microtúbulos. Cada proteÃ−na motora utiliza la hidrólisis del ATP para mover la vesÃ−cula u orgánulo en la célula. Se han identificado dos familias de proteÃ−nas motoras asociadas a los microtúbulos (MTs): las quinesinas y dinesinas. 33 · Funciones de los microtúbulos (continuación): La Quinesina y la dineina transportan en sentidos contrarios. La mayorÃ−a de las quinesinas se mueven desde el extremo - al extremo + y las dineinas en sentido contrario (Fig.9). Tanto las quinesinas como las dineinas tienen unas cabezas globulares que es donde se une el ATP que está en contacto con el microtúbulo, mientras que la vesÃ−cula que se transporta está en el extremo opuesto. Cada molécula de quinesina I tiene dos cadenas pesadas y dos cadenas ligeras (menos aminoácidos). Las dos cadenas pesadas incluyen las cabezas globulares, una zona de la molécula en doble hélice y la cola en el otro extremo. Las cadenas ligeras se situan tambien en la cola de la molécula. La Quinesina I se va moviendo a lo largo del mismo protofilamento del microtúbulo (MT's). En las neuronas, el neurotransmisor se sintetiza en el soma, la parte de la célula donde esta el núcleo, y esas vesÃ−culas que contienen el neurotransmisor tienen que llegar hasta el final del axón. Esto se denomina “transporte anterógrado” y se realiza mediante quinesinas. 4) Los microtúbulos interfñasicos estan implicados en el posicionamiento de otros orgánulos de la célula, como el retÃ−culo endoplasmático o el aparato de Golgi (Fig.11). 5) Movimiento de los cilios y flagelos: Ambos tienen la misma estructura, pero varia el número. Los cilios permiten a las células inmóviles desplazarse, como se da en el movimiento del óvulo por el epitelio de las trompas de Falopio. Los cilios tambien sirven para extender el mucus por los epitelios del sistema respiratorio. El flagelo sirve para propulsar una célula (espermatozoide). Ambos son evaginaciones de ma membrana plasmática (MP) en la que hay un conjunto de microtúbulos (MT's) que se llaman “el axonema”. El centro organizador de los microtúbulos (MT's) de los cilios y los flagelos es el “cinetosoma” o “cuerpo basal” y su ultraestructura es idéntica a la de un centrÃ−olo. El axonema esta formado por nueve pares de microtubulos (MT's) mas un par de microtubulos central. Por ello se dice que tienen una estructura 9+2. cada doblete de microtubulos (MT's) está formado por un microtubulo A completo con sus 13 protofilamentos, mientras que el B es incompleto y comparte algunos protofilamentos con el A (Fig.13). Cada doblete está conectado entre si por una proteÃ−na que se llama “nexina”. De cada microtubulo A sale una proteÃ−na hacia el centro llamada “espina radial”. El par de microtúbulos trales está rodeado asimismo por una envuelta proteica que se denomina “vaina interna”. De cada microtubulo A parten dos brazos de dineina, uno interno y otro externo. · Funciones de los microtúbulos (continuación): 34 5) Cilios y flagelos (continuación): Cada centriolo o cuerpo basal esta formado por nueve tripletes de microtubulos (MT's) y no hay ninguno en el centro (estructura 9+0). Cada triplete está formado por el microtubulo que esta completo y los microtubulos B y C que son incompletos. Existen proteÃ−nas conectando los distintos tripletes (Fig.12). El centrosoma que tiene una célula en interfase esta formado durante el periodo G1 por un par de centriolos y el material pericentriolar. Esos centriolos se duplican durante las fases S y G2 de manera que cuando una célula inicia una mitosis, desorganiza los microtúbulos interfásicos y comienza a organizar el huso mitótico, donde cada polo del huso mitotico estará formado por un par de centriolos y el material pericentriolar (Fig.10). · Tema 15: Los Microfilamentos de actina: Cada microfilamento de actina (MFs) resulta de la polimerización de un monómero que es una proteÃ−na globular que se llama “Actina G”. Las moléculas de actina G se ensamblan en una doble hélice muy fina, de unos 8nm de diámetro, que se denomina “Actina F” o simplemente, microfilamento de actina. Cada molécula de Actina G tiene una determinada polaridad y cada molécula que está como monómero, lleva unido un ATP. Poco después de ensamblarse en el microfilamento, el ATP es hidrolizado (Fig.1 a 3). Es importante destacar que mientras la Actina G lleva un ATP, la molécula de tubulina de los microtúbulos lleva asociado GTP. Los microfilamentos de actina tambien presentan una polaridad, y presentan un extremo + que polimeriza y despolimeriza mas rapidamente que el extremo - (Fif.4). En la célula hay proteÃ−nas que actuan como caperuzas, bloqueando el extremo -, quedándose solo libre el extremo + para que el microfilamento (MFs) pueda crecer o decrecer (Fig.5). Los microfilamentos (MFs) son especialmente abundantes en las células musculares, ya que estan implicadas en la contracción muscular, aunque todas las células tienen microfilamentos. Funciones de los microfilamentos de actina (MFs): ⋅ Soporte mecánico ⋅ Transporte intracelular ⋅ Citocinesis en células animales ⋅ Adhesión al sustrato. Contactos focales. ⋅ Microvellosidades ⋅ Adhesión entre las células epiteliales (Bandas de adhesión) ⋅ Locomoción celular (lamelipodios) Funciones de los microfilamentos: 2) Los microfilamentos también tienen proteÃ−nas motoras asociadas que 35 utilizan la hidrólisis del ATP para moverse y transportar orgánulos en una célula. Son la Miosina I y la Miosina V. Todas las funciones que realizan los microfilamentos dependen de las proteÃ−nas con que se asocien. Existen entre otros, tres tipos de miosina (I, II y V). En el transporte de vesÃ−culas solo están implicadas la miosina I y la Miosina V (Fig.10). Cada molécula de miosina tiene una o dos cadenas pesadas y varias cadenas ligeras. La miosina I es capaz de transportar una vesÃ−cula a lo largo del microfilamento desde el extremo - al extremo +, pero también puede desplazar microfilamentos hacia la membrana plasmática (Fig.11). En el axón de las neuronas, vesÃ−culas del neurotransmisor llegan al final del axón gracias a la quinesina. Pero como en el último tramo no hay microtúbulos, esas vesÃ−culas acaban siendo transportadas por la miosina V. La miosina II es distinta de las otras. Para funcionar requiere que se ensamblen por los extremos de las colas varias moléculas de miosina II formando lo que se denomina un “filamento grueso” donde las cabezas globulares de las moléculas de miosina II quedan hacia fuera y en el centro queda una zona sin cabezas. La miosina II siempre está implicada en la contracción y es capaz de desplazar un microfilamento con respecto de otro (Fig. 13 y 14). En las células animales, la citocinesis se produce gracias a un anillo contráctil de microfilamentos que interactúan con miosina II (Fig.15). 4) Adhesión a sustratos: Los microfilamentos forman haces paralelos que recorren el citosol y que se llaman “fibras de estrés”. Esos microfilamentos están unidos por una proteÃ−na llamada alfa- actinina. Cerca de la membrana plasmática, las fibras de estrés establecen contacto indirecto con moléculas de la matriz extracelular (MEC) en los denominados “contactos focales” que inducen la adhesión de la célula al sustrato (Fig.16 y 18). 5) Microvellosidades: Cada microvellosidad es una prolongación de la membrana plasmática en cuyo interior hay un haz de microfilamentos de actina conectados entre si por proteÃ−nas como la vilina y la fimbrina. Las microvellosidades aumentan la superficie de adhesión de la célula y por eso existen en las células del epitelio del intestino delgado (Fig.17). Funciones de los microfilamentos (continuación): 6) Adhesión entre células epiteliales: Bandas de adhesión (ver tema de uniones celulares). Están formadas por un haz de microfilamentos a modo de cinturón que recorre toda la célula justo por debajo de la membrana plasmática, habiendo moléculas de Cadherinas interaccionando en el espacio Inter.-celular. Este tipo de diferenciación esta implicada en la 36 adhesión entre las células (Fig.19). 7) Locomoción celular: Se ha estudiado fundamentalmente en fibroblastos en cultivo. Estas células se desplazan emitiendo lamelipodios en la dirección del movimiento. Cada lamelipodio contiene microfilamentos y se crean nuevos contactos focales, mientras que la parte posterior de la célula se retrae (Fig.20). 1)Soporte mecánico: Los microfilamentos de actina tienen distinta disposición en distintas partes de una misma célula. En general justo por debajo de la membrana plasmática suele haber microfilamentos formando redes tridimensionales. Esto se consigue porque hay una proteÃ−na llamada “filamina” que une distintos microfilamentos. De esta forma, la corteza celular es mas densa, tiene una estructura de gel. Por su parte, la zona mas interna de la célula es mas fluida ya que tiene una estructura de “sol” (Fig. 6 y 7). En el interior de la célula los microilamentos muchas veces son cortados por una proteÃ−na llamada “gelsolina” (Fig.8). Este hecho esta implicado en la emisión de pseudópodos. · Los filamentos Intermedios: A diferencia de los otros dos componentes, el monómero de los filamentos intermedios (FI) no es globular, sino filamentoso. Tampoco se componen de una sola proteÃ−na. Cada una de estas proteÃ−nas tiene una forma alargada, con los extremos globulares y se considera que es la unidad de embalaje al tetrámero (Fig.1). Dos dÃ−meros forman el tetrámero, ligeramente desplazados uno con respecto del otro, y a la vez cada dÃ−mero es una doble hélice de dos moléculas de un monómero. Una vez ensamblados los tetrámero, el filamento intermedio (FI) tiene forma de cuerda con 10 nm de diámetro. Su función principal es estructural, son faciles de doblar, difÃ−ciles de romper, y no se conocen proteÃ−nas motoras asociadas. Tampoco presentan polaridad estructural, no unen nucleótidos (ni ATP ni GTP) y hay gran variedad de tipos de filamentos intermedios (FI). Clasificación de los filamentos intermedios (FI) (Fig.2). Los filamentos intermedios de las células epiteliales están compuestos de queratina y conectan los desmosomas y los hemidesmosomas. Nota: http://multimedia.mcb.harvard.edu/anim_innerlife_hi.html · Tema 17: El ciclo celular El ciclo celular se compone de la Interfase y de la mitosis y su duración depende del tipo celular en el organismo. La interfase esta subdividida en tres etapas, la G1, la S, en la que se replica el ADN y la G2 (Fig.2). Las células en cultivo tienen un ciclo celular de aproximadamente entre 18 y 24 horas, de las cuales la mitosis dura aproximadamente dos horas. El ciclo celular esta controlado y regulado por unos complejos enzimaticos que son 37 las ciclinas asociadas a las quinasas dependientes de ciclina (Fig.3). Estas ciclinas y sus quinasas asociadas regulan que la célula vaya atravesando las distintas etapas del ciclo y vaya pasando por distintos puntos de control (Fig.4). En la célula cancerosa, los puntos de control o checkpoints del ciclo celular están alterados. Una de las proteÃ−nas mas importantes que controlan el ciclo es la proteÃ−na p53 (nombre que viene de su peso molecular). Es “el guardián del genoma”, ya que cuando una célula sufre lesiones en el ADN, aumenta la sÃ−ntesis del p53 lo que tiene dos efectos. Por un lado detiene el ciclo celular para reparar el ADN. Por otro y si esto no fuera posible, la célula entra en apoptosis, eliminando las células dañadas y potencialmente cancerÃ−genas (Fig.5). La interfase (Fig.6) Durante la interfase, la célula aumenta de tamaño. Se producen la replicación del ADN de los cromosomas y la duplicación del centrosoma. La Profase (Fig.7) En la profase, los cromosomas replicados están constituidos por dos cromátidas hermanas condensadas y estrechamente unidas. Fuera del núcleo, el huso mitótico une los dos centrosomas que se han replicado y separado. La Prometafase (Fig.8): Desorganización de la envoltura nuclear mediante la fosforilación de la lamina nuclear. En este momento los cromosomas se unen a los microtúbulos del huso mitótico mediante sus cinetocoros (centrómero) y comienzan su desplazamiento. La Metafase (Fig.9) Los cromosomas se sitúan en la placa ecuatorial. Se alcanza el máximo grado de condensación del ADN. El huso mitótico está completamente formado y consta de dos polos que actúan como centros organizadores de microtúbulos (CMOTs). Cada polo del huso consta de dos centriolos y el material pericentriolar y de cada polo parten tres tipos de microtúbulos (MTs)(Figs. 11 y 12): ⋅ Microtubulos cinetocóricos: Salen del polo y llegan hasta el cinetocoro de los cromosomas. ⋅ Microtúbulos polares: Salen del polo y llegan al ecuador del huso, donde se solapan con los microtúbulos polares del otro polo. ⋅ Microtúbulos astrales: Salen de cada polo y van hacia la periferia de los polos. Anafase (Fig.13) Cada cromátida se va a un polo del huso mitótico. A lo largo de la anafase se va a producir un alargamiento del huso que tenia forma de barril en la 38 metafase. Dentro de la anafase se distinguen dos etapas, la Anafase A y la Anafase B. No se debe confundir estas etapas con las Anafases I y II de la meiosis! • Anafase A: Se produce un acortamiento por despolimerización de los microtúbulos cinetocoricos, lo que hace que se separen las cromátidas hermanas. Esta despolimerizacion implica una perdida de monómeros de tubulina a nivel del cinetocoro (Fig.14a). • Anafase B: Se produce una separación de los polos del huso y alargamiento del huso mitótico. Los microtúbulos polares se alargan por polimerización del extremo +. Para que los polos se separen, además de crecer los microtúbulos polares, tienen que actuar proteÃ−nas motoras del tipo de las quinesinas que empujen y separen estos polos del huso. Este efecto se consigue también gracias a la participación de dineinas asociadas a la membrana plasmática que caminan sobre los microtúbulos astrales hacia el polo. En Resumen: Anafase A: separación de las cromátidas hermanas Anafase B: separación de los polos y alargamiento del huso mitótico. Telofase (Fig.16) Durante la telofase, los dos juegos de cromosomas hijos llegan a los polos del huso y se descondensan. Se reorganiza una nueva envoltura nuclear alrededor de cada uno de los dos conjuntos, completándose la formación de los dos núcleos que indica el final de la mitosis. La división del citoplasma comienza con la organización del anillo contráctil. Citocinesis (Fig.17) Durante la citocinesis, el citoplasma se divide en dos mediante un anillo contractil de filamentos de actina y miosina II que estrangula la célula por la mitad, dando lugar a dos células hijas, con sus respectivos núcleos. La Meiosis: Es una forma especial de división celular presente en la reproducción sexual, que da lugar a una mayor variabilidad génica, lo que permite sobrevivir a una especie en un medio que varÃ−a. Su división forma los gametos. A partir de una célula diploide, en la meiosis se forman cuatro células con distinta información génica, mientras que en la mitosis una célula diploide forma dos células diploides idénticas (Fig.1). La meiosis aporta variabilidad génica por dos mecanismos: ⋅ Segregación al azar de cromosomas homólogos paternos y maternos entre las células hijas en la división meiotica. Se forman por este mecanismo 2n gametos diferentes, lo que en la especie humana implica 223 gametos distintos. 39 ⋅ En la interfase I se intercambian fragmentos homólogos, lo que implica la rotura de las dobles hélices de ADN y su inserción en otra cadena por medio de la recombinación génica. · Etapas de la meiosis: División meiotica I: Profase I: Es la etapa mas larga de la meiosis y se divide en cinco subfases: -Leptotene -Cigotene -Paquitene -Diplotene -Diacinesis Durante esta fase se va produciendo una condensación del ADN, acortándose éste cada vez mas. Durante la subfase Leptotene y Cigotene, se forma el complejo sinaptonémico que permite el apareamiento de los cromosomas homólogos. El complejo sinaptonémico está formado por una región central y dos elementos laterales que mantienen unidos los cromosomas. Por el centro entre los dos cromosomas también actúan los nódulos de recombinación, los cuales cortan las moléculas de ADN y las unen en la otra cromátida (del cromosoma homólogo) con lo que se han intercambiado (Fig.6 y 7). Al final de la subfase de cigotene, el complejo sinaptonémico está ya completamente formado y durante la subfase Paquitene tiene lugar el sobrecruzamiento, es decir, el intercambio de segmentos entre cromátidas homólogos, intercambio que no se puede visualizar con el microscopio. Durante esta subfase se habla también de cromosomas bivalentes, al encontrarse los dos cromosomas homólogos unidos por el complejo sinaptonémico (Fig.5). Durante las subfases diplotene y ciacinesis, se puede observar que ha habido recombinación génica, ya que se observan los quiasmas, que son los puntos en los que se han intercambiado segmentos entre las cromátidas. Durante estas subfases también empieza a desorganizarse el complejo sinaptonémico, dejando los cromosomas homólogos unidos solo por los quiasmas. Al final de la diacinesis empezará la desorganización de la envoltura nuclear y la célula se prepara para su primera división. 40 División meiotica I (continuación): Metafase I: Durante la metafase I, los cromosomas bivalentes, unidos por los quiasmas, se sitúan en la placa ecuatorial, listos para ser separados. Anafase I: Se separan los cromosomas homólogos y se va uno a cada uno de los polos (Fig.8). Telofase I: Se reorganiza la envoltura nuclear sobre cada uno de los dos núcleos de cromosomas que se han separado. De esta forma, a partir de una célula que ha sufrido la primera división meiotica, después de la citocinesis, se forman dos células con la mitad de cromosomas (2n n + n). División meiotica II: La segunda división meiotica es muy similar a una división mitótica normal. La única diferencia es que en la división meiotica II no hay replicación del ADN, puesto que cada cromosoma ya esta compuesto por dos cromáticas (las cuales, sin embargo y debido a la recombinación génica, no son idénticas). De esta forma, en la metafase II los cromosomas se sitúan en la placa ecuatorial y en la Anafase II se separan cromátidas. Tras la citocinesis, se habrán formado por tanto cuatro cigotos con cromátidas distintas y la mitad de información genética. Antes de la fecundación, los cigotos tendrán que duplicar sus cromátidas, para tener cromosomas con dos cromátidas hermanas (Fig.9). · Tema 19: Gametogénesis y fecundación: La gametogénesis es el proceso de formación de los gametos, por eso se distinguen la espermatogénesis (formación de los gametos masculinos) de la ovogénesis (formación de los gametos femeninos). La Espermatogénesis: La espermatogénesis tiene lugar en las gónadas masculinas (testÃ−culos) que contienen los denominados “tubos seminÃ−feros” donde se forman los espermatozoides. Las células que hay en los tubos seminÃ−feros, llamadas espermatogonias se dividen por mitosis para que siempre haya una población de mantenimiento. Algunas de estas espermatogonias, que son diploides, empiezan su proceso de diferenciación y se convierten en dos espermatocitos primarios, que también son diploides, mediante la primera 41 división meiotica. Durante la segunda división meiotica se convierten en cuatro espermatocitos secundarios haploides. Estos espermatocitos tienen que sufrir un ultimo proceso de diferenciación, llamado espermiogenesis, para transformarse en espermatozoides maduros (Fig. 9). · Reacción acrosómica: La reacción acrosomica permite que el espermatozoide pueda alcanzar la membrana plasmática del óvulo, la cual está rodeada por varias envueltas. Para ello se produce una fusión de la membrana plasmática del espermatozoide con la parte de la membrana del acrosoma mas próxima a esa membrana plasmática. De ese modo se libera el contenido que tiene el acrosoma, que son enzimas hidrolÃ−ticos. · Estructura del testÃ−culo: En el testÃ−culo existen unos túmulos seminÃ−feros donde se forman los espermatozoides. En cada tabulo seminÃ−fero las paredes están formadas por un tipo especial único de epitelio, que es el epitelio seminÃ−fero. Esa pared del tubo seminifero está formada por células perfectamente ordenadas que están sufriendo la espermatogenesis. Los espermatozoides maduros se sitúan en la luz del tubo seminifero. Entre estas células que sufren la espermatogenesis existen unas grandes células llamadas “células de sertoli”, cuya misión es ayudar y proteger a las células de la espermatogenesis. Cada tabulo seminÃ−fero está rodeado por una lámina basal y entre los túmulos hay tejido conjuntivo, y en este tejido se encuentran las células de Leydig, encargadas de producir la testosterona que pasará al torrente sanguÃ−neo. Por lo tanto, el testÃ−culo tiene una doble función: Formar espermatozoides y de glándula endocrina, ya que produce hormonas. · La Ovogénesis: Formación del à vulo Tiene lugar en las gónadas femeninas. El proceso comienza con las células llamadas Ovogonias que se dividen por mitosis en el ovario. Algunas de esas ovogonias se diferencian en ovocitos primarios (diploides) que inician la meiosis. En la Profase I, la meiosis se detiene y el ovocito primario desarrolla por debajo de la membrana plasmática los “gránulos corticales” y además se rodea de una serie de cubiertas. Cuando finaliza la primera división meiotica se forman dos células de diferente tamaño: Ovocito secundario (grande) y el primer corpúsculo polar (pequeño) y ambos son haploides. Después de la segunda división meiotica, se forma un óvulo y tres corpúsculos polares. 42 En el ovario de mamiferos, recubierto por un empitelio simple (una capa de células) y cúbico se localizan unas estructuras esféricas de desigual tamaño que contienen distintas etapas de la meiosis, llamadas “folÃ−culos ováricos”. El estadio menos maduro es el folÃ−culo primordial, que consiste en una célula que es el ovocito primario rodeado de una capa de células epiteliales planas. El segundo estadio es el de folÃ−culo primario unilaminar que consta del ovocito rodeado de una capa de células de forma cúbica. Ademas, por fuera de la membrana plasmática comienza a desarrollarse la zona pelucida. El siguiente estadio es el de folÃ−culo primario multilaminar. De tamaño mayor que el anterior, ya que la capa de células que le rodeaba se ha dividido por mitosis y ahora hay varias capas que reciben el nombre de gránulosa. La zona pelúcida está completamente formada y es una envuelta glucoproteica formada por tres proteinas: ZP1, ZP2 y ZP3. EL siguiente es el folÃ−culo secundario, de mayor tamaño porque las células de la granulosa empiezan a fabricar un lÃ−quido que se localiza entre ellas. También comienza a desarrollarse la llamada “TECAS” que rodea por fuera toda la estructura y que va a fabricar hormonas. Por esto, el ovario tiene dos funciones al igual que los testÃ−culos: hacer óvulos y actuar como glandulas endocrinas. El lÃ−quido que se acumula en la granulasa se llama liquido granula y acaba por desplazar el ovocito del centro del folÃ−culo. El ultimo estadio se llama folÃ−culo de graaf. Tiene un gran tamaño y siempre se localiza muy cerca de la superficie del ovario. El ovocito esta completamente desplazado del centro, rodeado por varias capas de células de la granulasa que constituyen la llamada “corona radiada””. El lÃ−quido folicular ocupa casi todo el espacio del folÃ−culo. En el momento de la ovulación en mamÃ−feros, el folÃ−culo de graaf se rompe y se rompe el epitelio que cubre al ovario. Lo que se libera no es un óvulo maduro. · Fecundación Es la fusión del material genético de un óvulo y un espermatozoide para formar un huevo/cigoto que por posterior mitosis y diferenciación originan un nuevo individuo. De todos los espermatozoides que llegan al ovocito expulsado, algunos atraviesan las células de la corona radiada y el primero que llega a la zona pelúcida induce la liberación del contenido del acrosoma, lo que le permite penetrar esta zona. A continuación se fusionan la membrana del óvulo y el espermatozoide y entra su núcleo, aunque no el resto de los componentes de la célula del espermatozoide. La reacción acrosomica en la zona pelúcida. 43 Inmediatamente después de que el primer espermatozoide haya entrado en contacto con el ovocito se produce la liberación de los gránulos corticales por exocitosis, que alteran la proteÃ−na de la zona pelúcida e impiden que ningún otro espermatozoide pueda atravesar esta zona. De esta forma se evita la poliespermia. Una vez que ha entrado el núcleo del espermatozoide, el ovocito secundario, detenido en metafase, continua ala segunda división meiotica. A continuación se aproxima el núcleo del óvulo y del espermatozoide, denominados pronucleos masculino y femenino y ambos duplican su material genético, es decir, pasan de n a 2n. En mamÃ−feros no hay fusión de núcleos. Directamente se rompen las envolturas nucleares y los cromosomas se sitúan en la placa ecuatorial, continuando con la primera división mitótica y creando dos células idénticas. La fecundación en mamÃ−feros tiene lugar en el primer tercio de las trompas de Falopio. Una vez producido el huevo, continua dividiéndose y llega al útero, donde se produce la implantación. RESUMENES DE LOS TEMAS: Tema: 2. RESUMEN · Membranas Plasmáticas: • Estructura: Bicapa lipÃ−dica en “mosaico fluido” • Funciones: Es el lÃ−mite entre la célula y el medio. Regulan el paso de sustancias, participan en la “transducción de señales”, en la actividad enzimática, en la adhesión de la célula a la matriz extracelular (MEC), y en el movimiento y secreción de la célula. • Composición de la membrana: LÃ−pidos, ProteÃ−nas y hidratos de carbono • Composición de los lÃ−pidos: • La componen los fosfolÃ−pidos (que componen la bicapa), colesterol (que da rigidez a la membrana) y los glicolÃ−pidos. • Son anfipáticos y tienen las propiedades de autoensamblaje, autosellado, son móviles y están asimétricamente distribuidos: • Monocapa interna: Fosfatidilserina, fosfatidilinositol, fosfatiletanolamina • Monocapa externa: Esfingomielina y fosfatidilcolina • Composición de las proteÃ−nas: • Son las encargadas de hacer las funciones de la membrana plasmática y las hay de dos tipos: • Integrales o transmembranosas: De paso único o múltiple, normalmente en alfa-hélice (aunque tb en beta-laminar), son anfipáticas y tienen sus aminoácidos sin carga en el medio y aquellos con carga en el medio externo. • Periféricas: En la monocapa interna estan unidas covalentemente a ácidos grasos, en la monocapa externa lo estan a glicolÃ−pidos, aunque también se enlazan no covalentemente en ambas capas. 44 • Caso especial de los proteoglicanos (PGs): que son transmembranosos, unen la célula a la MEC, responden a estÃ−mulos y participan en la transducción de señales y se unen a glucosaminoglicanos. • Hidratos de carbono: • Solo se encuentran en la monocapa externa, son cortos y ramificados. • Estan unidos covalentemente a proteÃ−nas (glicoproteinas) o a lÃ−pidos (GlicolÃ−pidos) • Hay 9 monosacaridos muy abundantes, de ente los cuales los mas importantes son: • Glucosa, ácido siálico, manosa, fructosa y galactosa. • Glicocálix: • Es una cubierta rica en hidratos de carbono • Sirve para la protección mecánica de la célula, además de la identificación y reconocimiento entre células. Tema: 3. RESUMEN · Transporte a través de la membrana: • La membrana es semipermeable (permeabilidad selectiva) y hay 4 vias para el transporte a través de la misma: ⋅ Difusión simple ⋅ Difusión facilitada ⋅ Transporte activo ⋅ Transporte activo secundario ⋅ Difusión simple: • Paso directo a través de la membrana plasmática • Solo pueden pasar sustancias pequeñas y sin carga • Siempre el paso es a favor de gradiente y sin gasto de energÃ−a • El agua (H2O) pasa por las “acuaporinas”: ProteÃ−na de canal ⋅ Difusión facilitada: • Para iones (moléculas con carga) y moléculas grandes • Hay dos tipos de proteÃ−nas encargadas del transporte: • Transportadoras (carriers o permeasas): ♦ El soluto se adhiere a la proteÃ−na, cambia de forma y deja salirlas al otro lado. ♦ Uniporte (transporta una molécula) ♦ Cotransporte (dos moléculas diferentes): Simporte (mismo sentido), antiporte (sentido contrario). ♦ ProteÃ−nas de canal: ◊ Son proteÃ−nas transmembranosas con un canal que las atraviesa y atraviesa toda la membrana. ◊ Permite el paso a iones especÃ−ficos ◊ Tienen compuertas que pueden cerrarse y no permanecen siempre abiertos. ◊ Pueden ser de ligando (partÃ−cula que abre o cierra) o de voltaje. ♦ Transporte activo: ◊ Es siempre contra gradiente ◊ Requiere un gasto de energÃ−a ◊ El mejor ejemplo es la bomba sodio-potasio (Contransporte antiporte que saca 3 Na+ y deja 45 entrar 2 K+ gastando 1/3 de la energÃ−a de la célula) ♦ Transporte activo secundario: ◊ Es un transporte activo especial, mejor ejemplo: Glucosa en las microvellosidades del epitelio del intestino delgado: ◊ Entra glucosa contra gradiente arrastrada por 2 iones Na+ que entran a favor de gradiente ◊ Cotransporte, simporte, sin gasto de energÃ−a directo ◊ El gasto de energÃ−a es indirecto y viene de la bomba sodio-potasio que tiene que sacar los iones Na+ de la célula. · Transporte de macromoléculas: ◊ Hay cuatro tipos diferentes: ♦ Endocitosis ♦ Endocitosis mediada por receptor ♦ Fagocitosis ♦ Exocitosis ♦ Endocitosis: ◊ VesÃ−culas rodeadas por bicapa lipidica de la membrana plasmática atrapa macromoléculas del medio externo. ♦ Endocitosis mediada por receptor: ◊ Adaptina, proteÃ−na transmembranosa en la membrana plasmática reconoce y sujeta macromoléculas especÃ−ficas. ◊ Clatrina rodea la adaptina e invagina la membrana plasmática, atrapando la macromolécula. ◊ Dinamina estrangula la membrana plasmática, creando la vesÃ−cula. ◊ La vesÃ−cula suelta la adaptina y la clatrina, se fusiona en el “endosoma temprano” con otras vesÃ−culas iguales, y recicla los receptores que vuelven a la membrana plasmática. ◊ Después, los lisosomas se funden con el “endosoma temprano” e hidrolizan o deshacen las macromoléculas. ◊ En algunos casos especiales, las macromoléculas no son hidrolizadas (transcitosis). ♦ Fagocitosis: ◊ Una célula fagocitante atrapa bacterias u células viejas o defectuosas con pseudópodos, los introduce dentro de la célula y los descompone con lisosomas. ♦ Exocitosis: ◊ VesÃ−culas rodeadas por bicapa lipÃ−dica se fusionan y se unen a la membrana plasmática, expulsando el contenido al medio externo. ◊ Hay dos tipos, constitutiva, común a todas las células, o regulada, especifica de las células 46 secretoras y mediadas por señal. Tema: 4. RESUMEN · Tema 4. Superficie Celular ◊ La matriz extracelular (MEC) es el espacio entre las células. Contiene gran cantidad de macromoléculas fabricadas por las células que la rodean. ◊ Función: tiene una función estructural, como soporte mecánico, pero también una función reguladora de la mogración y proliferación celular, asÃ− como de sus funciones metrabólicas. ◊ Composición: Agua, macromoléculas (glicosaminoglicanos y proteÃ−nas): ♦ Glicosaminoglicanos unidos a proteoglicanos (PGs). Son polisacaridos lineales no ramificados compuestos por disacáridos con carga negativa que retienen agua. ◊ Principales:: ácido hialuronico, Dermatán sulfato, Condrotin sulfato, queratan sulfato y heparan sulfato. ♦ ProteÃ−nas estructurales: Son el colágeno y la elastina ◊ Colágeno: Es el mas abundante en el organismo, se han clasificado 20 tipos diferentes. En los fibroblastos se forman en alfa-hélice, para luego organizarse en la matriz extracelular (MEC) en fibras de colágeno. ◊ Elastina: Forman fibras en la Matriz extracelular (MEC) mediante uniones cruzadas y son capaces de estirarse y relajarse. ♦ ProteÃ−nas adhesivas: ◊ La fibronectina en la matriz extracelular (MEC). Esta formada por dos cadenas polipeptÃ−dicas con dos puentes de disulfuro en el extremo carboxilo. Se une a proteoglicanos, colágenos y receptores celulares como la integrina. · Adhesión celular: ◊ Interacciones entre la superficie celular que no dan lugar a estructuras visibles al microscopio electrónico. Hay tres formas diferentes: ◊ HomofÃ−lica ◊ HeterofÃ−licas ◊ A través de moléculas de la matriz extracelular ◊ En las interacciones célula-célula, existen cuatro familias de proteÃ−nas que intervienen: ◊ Cadherinas ◊ Ig CAMs ◊ Selectina ◊ Integrina · Tema 4. Superficie Celular (continuación): Cadherinas: 47 ◊ Son proteÃ−nas transmembranosas de largo dominio extracelular y que requieren iones calcio (Ca++). Actúan en dÃ−meros (parejas) alfa y beta e interaccionan homofÃ−licamente con otras cadherinas. En el medio interno, interaccionan con el citoesqueleto (microfilamentos de actina) a través de la catenina (alfa, beta y p-120). Ig CAMs: ◊ Son proteÃ−nas transmembranosas de largo dominio extracelular, que forman 5 lazos unidos por puentes de disulfuro. Interaccionan homofÃ−licamente. Selectinas: ◊ Son proteÃ−nas transmembranosas de largo dominio extracelular, que reconocen oligosacáridos en la membrana plasmática. Dependen de iones calcio para funcionar, y tienen un papel fundamental en la extravasación de los leucocitos. Integrinas: ◊ Son receptores de la membrana plasmática formadas por dos subunidades (alfa y beta) y que necesitan iones calcio o magnesio para funcionar. Interaccionan con el citoesqueleto (microfilamentos de actina) mediante otras proteÃ−nas, y en la matriz extracelular (MEC) interaccionan homofÃ−licamente con otras integrinas, aunque también con la fibronectina. · Diferenciaciones de la membrana plasmática: Dominio Apical: ◊ Cilios y flagelos: Una célula puede tener muchos cilios, pero solo un flagelo. Sirven para el movimiento de la célula o de productos de la misma (ovulo, mucus). En su interior tienen microfilamentos de actina en disposición (9 2). ◊ Microvellosidades: Son pliegues de la membrana plasmática que sirven para crear un aumento de superficie de contacto. Dentro de cada microvellosidad hay un haz de microfilamentos de actina y las microvellosidades mas estudiadas son las del epitelio del intestino delgado. Dominio Lateral: ◊ Uniones herméticas: En la parte lateral de las células, por debajo de la lÃ−nea de las microvellosidades y donde la célula se une a la célula adyacente, hay hileras o filas de proteÃ−nas transmembranosas conectadas a mismo nivel (como cosidas). Las proteÃ−nas son la 48 claudina y la Ocludina y se encargan de sellar el espacio intercelular para evitar el escape de productos de la digestión y el desplazamiento de proteÃ−nas del dominio apical. · Diferenciaciones de la membrana plasmática (continuación): Dominio Lateral: ◊ Bandas de adhesión: es un haz de microfilamentos de actina a modo de cinturón por debajo de la union hermética. Ayudan a la unión celular y actua mediante unas proteÃ−nas transmembranosas llamadas cadherinas. ◊ Desmosomas: Actuan puntualmente y constan de dos placas proteicas unidas por cadherinas. Filamentos intermedios de queratina las conectan con otras placas de la célula, incluidos los hemidesmosomas. ◊ Uniones comunicantes (nexos / Gaps): Connexones formados por 6 proteÃ−nas conexinas que forman un canal o poro, que permite el paso de pequeñas moléculas, iones y nucleótidos. Pueden estar abiertas o cerradas, según la conformación de las conexinas. Dominio Basal: ◊ Hemidesmosomas: Sirven para la adhesión de la célula a la lámina basal. Constan de una placa proteica de plectina que interacciona con integrinas. Las placas están unidas por filamentos intermedios de queratina a otros hemidesmosomas y a los desmosomas de la célula. La composición quÃ−mica entre los desmosomas y los hemidesmosomas es completamente diferente. ◊ Contactos focales (placas de adhesión): Interaccionan con microfilamentos de actina conformados en fibras de estrés (rejillas) en el medio interno, mientras en la Matriz extracelular (MEC) se unen mediante integrinas. La célula puede organizar y desorganizar estos contactos focales a voluntad, por lo que sirven para la adhesión y el movimiento de la célula. Tema: 5 RESUMEN · Tema 5. Señalización ◊ Es la capacidad de la célula de responder a estÃ−mulos externos. ◊ Las moléculas señal pueden ser: hormonas, factores de crecimiento, gases y neurotransmisores. ◊ Las células necesitan recibir señales o de lo 49 contrario inician la apoptosis. ◊ Entre las reacciones posibles están: Dividirse, sobrevivir, diferenciarse, moverse, cambiar su metabolismo, etc. ◊ Hay 2 tipos de receptores: de superficie celular e intracelulares. ◊ Una misma molécula señal puede provocar diferentes respuestas en diferentes células. ◊ Existen dos tipos de señalización: Directa y por secreción Directa: una célula tiene una molécula señal en su membrana plasmática y la lleva a otras células. Por secreción hay 3 tipos: ◊ Autocrina: Se produce una molécula señal que recibe la propia célula ◊ Paraerina: La molécula señal es secretada al medio y actúa en las células adyacentes. ◊ Endocrina: Principalmente son hormonas, las cuales son secretadas a la sangre y actúan muy lejos de donde fueron creadas. · Los receptores: Intracelulares: Para moléculas señal pequeñas e hidrófobas, se pueden encontrar en el citosol o en el núcleo. De superficie celular: Son moléculas señal hidrofÃ−licas y las hay de tres tipos: ◊ Asociados a canales iónicos (proteÃ−nas de canal reguladas por ligando) ◊ Asociados a proteÃ−na G que inicia una cascada de reacciones (“transducción de señales”) ◊ Receptores asociados a enzimas, que no veremos en este curso. ◊ También intervienen segundos mensajeros, como los iones calcio (Ca++) o el AMPcÃ−clico, en la transducción de señales y hay proteÃ−nas que actúan de interruptores activándose o desactivándose con fosfatos o GDP/GTP ◊ Las quinasas son enzimas que fosforilan ◊ Las fosfatasas son enzimas que desfosforilan 48 Código Postal Universidad Autónoma de Madrid: 28049 PGs = ProteÃ−na + cadena larga y lineal de hidratos de carbono (GLUCOSOMINOGLICANOS = GAGs) 50